Теплоемкость вещества. степени свободы молекул. Соотношение между теплоемкостью при постоянном давлении и при постоянном объеме.
Теплоёмкость- количество тепла при получении которого тело нагревается на 1 градус. Теплоёмкость [c], c- это теплоёмкость тела, а тело может иметь разную массу, поэтому вводится понятие удельной теплоёмкости [c]
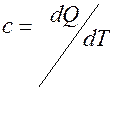
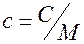 При изохорическом процессе V=const, если тело нагревается то работа равна 0. В этом случае передаваемое телу тепло идёт только на изхменение его внутренней энергии т.е. dQ=dU и в этом случае теплоёмкость равна изменению внутренней энергии при изменении температуры на 1 градус.
При изохорическом процессе V=const, если тело нагревается то работа равна 0. В этом случае передаваемое телу тепло идёт только на изхменение его внутренней энергии т.е. dQ=dU и в этом случае теплоёмкость равна изменению внутренней энергии при изменении температуры на 1 градус. , где
, где 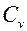 -теплоёмкость при постоянном объёме.
-теплоёмкость при постоянном объёме.  -эта энергия распределяется между тремя поступательными степенями свободы. В газе в виду беспорядочного движения молекул всё направление перемещения молекул равновероятны поэтому на каждую степень свободы поступательного движения приходится 1/3 E кинетической. I
-эта энергия распределяется между тремя поступательными степенями свободы. В газе в виду беспорядочного движения молекул всё направление перемещения молекул равновероятны поэтому на каждую степень свободы поступательного движения приходится 1/3 E кинетической. I  - степень свободы,
- степень свободы, 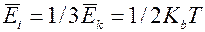 Но в случае многоатомных газов молекулы представляют собой систему способную вращаться как целое. При этом атомы молекул могут совершать колебания вблизи своих положений равновесия. Таким образом общее число степеней свободы больше числа степеней свободы атома одноатомного газа. Колебательное движение имеет особенность: средняя энергия колебательного движения есть сумма средне кинетической энергии и равной ей средней потенциальной энергии следовательно средняя энергия молекулы
Но в случае многоатомных газов молекулы представляют собой систему способную вращаться как целое. При этом атомы молекул могут совершать колебания вблизи своих положений равновесия. Таким образом общее число степеней свободы больше числа степеней свободы атома одноатомного газа. Колебательное движение имеет особенность: средняя энергия колебательного движения есть сумма средне кинетической энергии и равной ей средней потенциальной энергии следовательно средняя энергия молекулы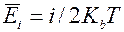
 Выражение отражает теплоёмкость одного моля идеального газа и называется молярной теплоёмкостью при постоянном объёме
Выражение отражает теплоёмкость одного моля идеального газа и называется молярной теплоёмкостью при постоянном объёме
Для идеального газа справедливо соотношения
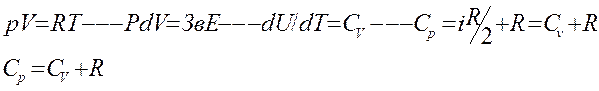
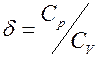 -величина характерная для каждого газа и определяется числом степеней свободы молекул газа. Т.о. изменение теплоёмкости есть способ непосредственного получения микроскопических характеристик молекул из которых состоит тело-газ.
-величина характерная для каждого газа и определяется числом степеней свободы молекул газа. Т.о. изменение теплоёмкости есть способ непосредственного получения микроскопических характеристик молекул из которых состоит тело-газ.