Вильгельм Оствальд.
содержаться одинаковое число молекул. То есть измеряя массу веществ в граммах, химики как бы оперировали молекулами.
Так в химии появилась величина, которую называли грамм-молекулой или молем (слово «моль» придумал в начале XX в. немецкий физикохимик, лауреат Нобелевской премии Вильгельм Оствальд; оно содержит тот же корень, что и слово «молекула» и происходит от лат. moles — «масса»). Ещё недавно в учебниках и справочниках по химии писали: «Грамм-молекула (моль) — такое количество данного вещества, масса которого при выражении в граммах численно равна молекулярной массе этого вещества... Одна грамм-молекула любых индивидуальных веществ содержит одинаковое число молекул». Это определение моля сохранялось в течение почти целого столетия. Был измерен и объём одного моля вещества, находящегося в газообразном состоянии (при условии, что этот газ близок к идеальному): при нормальных условиях (давлении 1 атм=1,013•105 Па и температуре 0°С) он равен 22,4 л. Число же молекул в одном моле стали называть постоянной Авогадро.
В наши дни моль определяется иначе: это количество вещества, содержащего столько же структурных элементов (атомов, молекул, ионов или других частиц), сколько их содержится в 0,012 кг углерода-12. (О том, почему в качестве стандарта был выбран именно 12С, см. статью «В каждой ячейке».) В 1971 г. решением XIV Генеральной конференции по мерам и весам моль был введён в Международную систему единиц (СИ) в качестве седьмой основной единицы. В современном определении постоянная Авогадро (её обычно обозначают NA) —
ГАЗ НА ГАЗ НЕ ПРИХОДИТСЯ...
В справочниках можно прочитать, что моль газа при нормальных условиях занимает объём 22,41108 л. Но это справедливо лишь в отношении так называемого идеального газа, для которого принимается, что между молекулами не действуют силы притяжения или отталкивания, а объём самих молекул пренебрежимо мал. Очевидно, что такого газа в природе нет, а реальные газы в большей или меньшей степени отклоняются от законов, писанных для идеального. Между их молекулами всегда существуют силы притяжения, поэтому объём реального газа отличается от объёма идеального. Насколько — зависит от конкретного газа. Вот каковы округлённые мольные объёмы (при нормальных условиях) некоторых газов, рассчитанные из их плотностей:
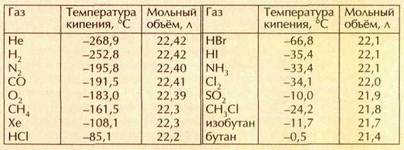
Тенденция очевидна — чем ближе температура кипения газа к 0 °С, тем сильнее он отличается от идеального. Уравнение для расчёта состояния реальных газов предложил в 1873 г. нидерландский физик Йоханнес Дидерик Ван-дер-Ваальс (1837—1923). В отличие от уравнения идеального газа pV = nRT, в уравнение Ван-дер-Ваальса (р+n2a/V2)(V-nb)=nRT вводятся поправки, которые определяются экспериментом. Первая поправка n2alV учитывает взаимодействие между молекулами реального газа (оно тем меньше, чем больше объём, т. е. чем ниже давление); вторая поправка nb учитывает собственный объём молекул газа.
Поправки становятся существенными при высоких давлениях газов. Так, для азота при давлении порядка 80 атм. расчёт по уравнению идеального и реального газа отличается примерно на 5 %, а с увеличением давления в 5 раз разница достигает уже 100%!
КТО АВТОР СТАТЬИ ЛОШМИДТА?
Появление второй статьи Лошмидта окружено некой тайной, которая, вероятно, никогда не будет разгадана. Дело в том, что в первой большой статье (почти 20 страниц) Лошмидт вывел формулу, позволяющую рассчитать значение NL. Однако сам он этот расчёт почему-то не сделал. Если в приведённую формулу подставить известные экспериментальные данные, получится, что NL=1,83•1018 — в 15 раз меньше современного значения (2,687•1019). Во второй статье впервые в научной литературе приводится значение постоянной Лошмидта: «866 биллионов/мм3», т. е. 8,66•1017 молекул/см3. Удивительно, что вторая статья (меньше двух страничек), хотя и подписана именем Лошмидта, по стилю сильно отличается от других его работ. Более того, приведённое в ней значение NL, как говорится, «взято с потолка», а в тексте много ошибок и опечаток...
ПОЧЕМУ НЕБО ГОЛУБОЕ
Постоянную Авогадро определяли множеством косвенных методов. Например, из голубого цвета неба следует, что солнечный свет рассеивается в воздухе. Если бы этого не происходило, мы видели бы Солнце на совершенно чёрном небе. Дж. У. Рэлей показал: интенсивность рассеяния света зависит от числа молекул воздуха в единице объёма (так же как рассеяние солнечного луча в тёмной комнате зависит от «концентрации» пыли в воздухе) и не зависит от размера молекул, если они малы по сравнению с длиной волны света. А значит, измерив соотношение интенсивностей прямого солнечного света и рассеянного голубым небом, можно определить постоянную Авогадро. Для измерений нужны были учёные-альпинисты, так как наблюдения следовало проводить высоко в горах, где нет помех от пыли и водяных капель. Впервые подобные измерения выполнил итальянский математик и видный политический деятель Квинтино Селла (1827— 1884) на вершине горы Монте-Роза (4634 м), что на самом юге Швейцарии. Расчёты, сделанные на основании этих и более новых измерений английским физиком Уильямом Томсоном (лордом Кельвином, 1824—1907), показали, что моль содержит не менее 3•1023 и не более 15•1023 молекул. Измерения (на той же горе) повторил в 1910 г. французский физик Леон Бриллюэн; он получил для постоянной Авогадро значение 6,0•1023, очень близкое к современному.
Другой метод использовал французский учёный Жан Батист Перрен (1870—1942). Он под микроскопом подсчитывал число крошечных, диаметром около микрометра (1 мкм=10-6 м), шариков краски гуммигута, взвешенных в воде. Перрен решил, что к ним применимы те же законы, которым подчиняются молекулы газов. В таком случае можно определить «молярную массу» шариков; зная же массу шарика (её, в отличие от массы настоящих молекул, можно измерить), легко рассчитать постоянную Авогадро, разделив первое значение на второе. У Перрена получилось примерно 6,8•1023.
это число частиц, содержащееся в моле любого вещества.
Ещё во времена Канниццаро для учёных было очевидно: поскольку атомы и молекулы неописуемо малы, постоянная Авогадро должна быть очень велика. Оперируя мольными количествами веществ, исследователи фактически использовали в неявном виде постоянную Авогадро, однако конкретное её значение никто даже представить не мог. Химиков данная проблема особенно не волновала: ведь и не зная, чему равна эта величина, они прекрасно справлялись со стехиометрическими расчётами.
ЗА ПОСТОЯННУЮ АВОГАДРО БЕРУТСЯ ФИЗИКИ
Постепенно физики научились определять размеры молекул и значение NA — сначала очень грубо, приблизительно, затем всё точнее. Прежде всего им было понятно, что обе величины связаны друг с другом: чем меньше окажутся атомы и молекулы, тем больше число Авогадро. Впервые размеры атомов оценил австрийский физик Йозеф Лошмидт (1821 — 1895). В 1865 г. он опубликовал работу, где, исходя из молекулярно-кинетической теории газов и экспериментальных данных об увеличении объёма жидкостей при их испарении, рассчитал диаметр молекулы азота. У него получилось 0,969 нм (нанометр — миллиардная часть метра, т.е. 1 нм=10-9 м). Это примерно втрое больше современного значения, но для того времени было хорошим результатом. Во второй статье за подписью Лошмидта, напечатанной в том же году, даётся и число молекул в 1 см3 газа, которое стали называть постоянной Лошмидта (NL). Из неё легко получить значение NA, умножив на мольный объём идеального газа. После Лошмидта значения NL (а также NA) определяли многие учёные. В XIX в. все эти определения были косвенными. В 1890 г. английский физик Джон Уильям Рэлей (1842—
НАСКОЛЬКО ВЕЛИК МОЛЬ?
Постоянная Авогадро настолько велика, что с трудом поддаётся воображению. Преподаватели и популяризаторы химии придумали десятки эффектных способов показать грандиозность этого числа. Вот некоторые из них.
В пустыне Сахара содержится менее трёх молей самых мелких песчинок.
Если футбольный мяч увеличить в NA раз по объёму, то в нём поместится земной шар. Если же в NA раз увеличить диаметр мяча, то в нём поместится самая большая галактика, включающая сотни миллиардов звёзд. Кстати, во Вселенной содержится примерно NA звёзд.
Если взять моль красителя (приблизительно стакан), пометить каким-либо способом все его молекулы, вылить в море и подождать, пока он равномерно распределится по всем морям и океанам до самого дна, то, зачерпнув в любом месте земного шара стакан воды, обязательно обнаружим в нём не один десяток «меченых» молекул.
При каждом вдохе человека в его лёгкие попадает несколько молекул кислорода и азота, которые находились в последнем выдохе Юлия Цезаря.
Если взять моль долларовых бумажек, они покроют все материки Земли двухкилометровым плотным слоем.
А этот пример создан по мотивам древней восточной легенды. В сказочном царстве находится огромная гранитная скала в виде куба с ребром, равным 1 км. Раз в столетие на скалу садится ворон и чистит о неё клюв, при этом скала стирается на 0,0001 г. Так вот, число лет, когда от скалы не останется ни одной песчинки, меньше, чем постоянная Авогадро.

1919) и независимо от него немецкий физик Вильгельм Конрад Рентген (1845—1923) провели такой эксперимент: они капали на воду оливковое масло и определяли размер масляного пятна на её поверхности. Зная объём масла V и площадь пятна S, легко рассчитать его толщину d=V/S. Толщина масляной плёнки получилась очень маленькой, всего 0,6— 1 нм, и физики решили, что именно такие размеры имеют молекулы масла. В принципе из этого значения можно получить постоянную Авогадро (хотя Рэлей и Рентген этого не сделали). Оливковое масло — сложная смесь, основной её частью является олеиновая кислота. Моль этой кислоты (182 г) занимает объём 205 см3. Если условно считать молекулы олеиновой кислоты кубиками с ребром 0,8 нм=0,8•10-7 см и, следовательно, объёмом 0,512•10-21 см3, то в объёме 205 см3 таких кубиков поместится 205/(0,512•10-21)=4•1023. Это отличается от современного значения постоянной Авогадро всего в 1,5 раза.
Благодаря развитию атомной физики в XX в. стало возможным измерить постоянную Авогадро «напрямую». В 1908 г. английский физик Эрнест Резерфорд и немецкий физик Ханс Гейгер (1882—1945) определили, что грамм радия испускает за секунду более 34 млрд. a-частиц — ядер атомов гелия.
Захватывая электроны, a-частицы превращаются в обычные атомы гелия, которые постепенно накапливаются в виде газа. Исходя из объёма гелия, выделенного радием за определённый срок, можно рассчитать число молей гелия, а зная скорость испускания a-частиц радием, найти и число атомов гелия в одном моле газа. Этот прямой способ подсчёта числа молекул в моле газа дал результат 6,1•1023.
Более точно постоянную Авогадро можно определить, измеряя рентгенографическим методом межатомные расстояния в кристалле. Современное значение этой постоянной NA=6,0221367•1023.
