рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- УСТРОЙСТВО ВЕЩЕСТВА
Реферат Курсовая Конспект
УСТРОЙСТВО ВЕЩЕСТВА
УСТРОЙСТВО ВЕЩЕСТВА - раздел Химия, ...
УСТРОЙСТВО ВЕЩЕСТВА
ИЗ ЧЕГО СДЕЛАН МИР
АТОМИСТИЧЕСКОЙ ТЕОРИИ Современные понятия элемента, атома и простого вещества, молекулы как совокупности связанных между собой атомов…Самая важная информация.
СТРОЕНИЕ АТОМОВ Многочисленные эксперименты, проведённые физиками в начале XX в.. показали,… Но если сравнивать не массы, а размеры, то окажется, что атом намного более «пустой», чем Солнечная система. Её…Четыре первоначала Аристотеля.

Титульный лист поэмы Лукреция
О природе вещей». Издание 1563 г.
...существуют тела, которых мы видеть не можем... Ведь осязать, как и быть осязаемым,Академия Платона. Мозаика. I в. до н. э.

Форма атомных орбиталей.
Нуклиды обозначают символом элемента и массовым числом: 12С, 14N, l6O; другая форма записи: углерод-12, азот-14, кислород-16. Если массовое число… изотопа водорода — нуклиды 1Н, 2Н (другое обозначение D — дейтерий) и 3Н (или… Если атом нейтрален, его положительно заряженное ядро удерживает столько же отрицательно заряженных электронов (е),…Изменение энергии орбиталей в зависимости
От порядкового номера элемента.
При переходе от твёрдого состояния вещества к газообразному взаимодействие между частицами ослабевает. химическая реакция). Эти свойства газов обусловлены тем, что молекулы в них находятся далеко друг от друга. Доля…Старинные термометры.
Слева — термометр, показывающий минимальную и максимальную температуру, которая наблюдалась с момента его установки.
В центре — термометр, показывающий температуру по Цельсию, Реомюру и Фаренгейту.
Справа — термометр конца XIX в. со шкалами по Реомюру и Цельсию.
Большинство твёрдых веществ находится в кристаллической форме: их частицы — молекулы, атомы или ионы — расположены в строгом порядке, образуя… Вместе с тем частицы в кристаллической решётке не неподвижны, они постоянно… ТЕКУТ ЛИ ОКОННЫЕ СТЁКЛА?Строение
Кристаллического (1) и аморфного (2) вещества.
Плазма— электрически нейтральный, сильно ионизированный газ, состоящий из положительно заряженных ионов, электронов и нейтральных молекул. Во… Чтобы превратить газ в плазму (ионизировать его), нужно затратить большую… Плазму можно создавать искусственно, подвергая нейтральный разреженный газ действию электрического поля (как в…Плазменная горелка.
Жидкие кристаллы— вещества, которые ведут себя одновременно как жидкости и как твёрдые тела. Молекулы в жидких кристаллах, с одной стороны,… правильное расположение молекул нарушается, и жидкий кристалл становится… Регулярное расположение молекул в жидких кристаллах обусловливает их особые оптические свойства. Свойствами жидких…Приглядевшись к сколу стекла, можно увидеть, что это твёрдое вещество имеет некристаллическую структуру.
ВОЛШЕБНОЕ ЧИСЛО ХИМИКОВ
Выдающийся немецкий философ Иммануил Кант как-то заметил, что в некоторых ветвях естественных наук истинной науки столько, сколько в них… Все эти идеи, известные сейчас даже школьнику, Рихтер изложил в 1793 г. в…Равные объёмы газообразных веществ при одинаковом давлении и температуре содержат одно и то же число молекул, так что плотность различных газов служит мерой массы их молекул...
Это добавление было очень важным: оно означало, что, измеряя плотность разных газов, можно определять относительные массы молекул, из которых они состоят. Например, если в 1 л водорода содержится столько же молекул, сколько и в 1 л кислорода, то отношение плотностей этих газов равно отношению масс молекул водорода и кислорода. В 1814 г. к тем же выводам пришёл известный французский физик Анд-ре Мари Ампер (1775—1836). Однако считать Ампера соавтором закона Авогадро, как это делали многие химики, вряд ли справедливо.
Во времена Авогадро его гипотезу нельзя было обосновать теоретически. Такая возможность появилась позднее, с развитием молекулярно-кинетической теории газов. Энергия удара молекул о стенки сосуда не зависит от массы молекул, а зависит только от температуры. Это происходит потому, что лёгкие молекулы движутся быстро, тяжёлые — медленно, а кинетическая энергия у них (при данной температуре) одинаковая.
Следовательно, равное число молекул в данном объёме оказывает одинаковое давление, и наоборот: равное давление двух газов свидетельствует об одинаковом числе молекул в них.
Закон Авогадро давал химикам возможность экспериментально устанавливать состав молекул газообразных соединений. Так, из найденного опытным путём соотношения объёмов водорода, кислорода и паров воды (2:1:2) логически можно сделать два вывода. Первый: молекулы исходных газов состоят из двух атомов, а молекула воды — из трёх, и тогда верно уравнение 2Н2+О2=2Н2О. Второй: молекулы водорода одноатомны, а кислорода и воды — двухатомны, и тогда верно уравнение 2Н+О2=2НО с тем же соотношением объёмов. (Кстати, даже через 50 лет после работ Гей-Люссака некоторые учёные продолжали настаивать на том, что формула воды именно НО, а не Н2О.)
Разрешить дилемму удаётся лишь на основании других опытов. Из них следует, например, что равные объёмы водорода и хлора образуют удвоенный объём хлороводорода. Этот факт сразу отвергает предположение об одноатомности водорода: реакция Н+Cl=НСl не даёт удвоенного объёма НСl. Следовательно, молекулы водорода (а также хлора и кислорода) двухатомны, и верно уравнение 2Н2+О2=2Н2О.
Удивительно, что такие простые доводы не могли убедить некоторых химиков в справедливости (и глубине) закона Авогадро. И, к сожалению, его теория несколько десятилетий оставалась практически незамеченной.
Основной причиной неприятия простой и стройной теории Авогадро была господствовавшая в те времена так называемая дуалистическая теория строения химических соединений, созданная Берцелиусом. Согласно ей, все атомы имеют электрические заряды, а молекулы образованы атомами с противоположными зарядами, которые притягиваются друг к другу. Считалось, в частности, что атомы кислорода обладают сильным отрицательным зарядом, а атомы

Амедео Авогадро.

Давление газа обусловлено ударами молекул о стенки сосуда.
В 30-х гг. XIX в. французский химик Жан Батист Дюма (1800— 1884) исследовал реакцию замещения водорода хлором в органических соединениях. В… Это обстоятельство решил обыграть известный немецкий химик Фридрих Вёлер. В… Либиху шутка понравилась, и он опубликовал сочинение Ш. Виндлера (на французском языке) всего через несколько страниц…Вильгельм Оствальд.
Так в химии появилась величина, которую называли грамм-молекулой или молем (слово «моль» придумал в начале XX в. немецкий физикохимик, лауреат… В наши дни моль определяется иначе: это количество вещества, содержащего… ГАЗ НА ГАЗ НЕ ПРИХОДИТСЯ...Схема опыта Э. Резерфорда и X. Гейгера
по подсчёту числа a-частиц. Эти частицы,
попадая через малое отверстие на экран,
Покрытый фосфоресцирующим
Составом ZnS, вызывают на нём
Вспышки света, за которыми следят
Через увеличительное
Стекло.
ХИМИЧЕСКАЯ СВЯЗЬ

Фридрих Август Кекуле.
Важное открытие, касающееся химической связи, принадлежит нидерландскому химику Якобу Вант-Гоффу. Он доказал, что четыре связи атома углерода в… Несмотря на многие гениальные догадки о строении молекул, природа связи между… ТЕОРИЯ ЛЬЮИСА, ИЛИ ЭЛЕКТРОННЫЙ «КОЛХОЗ»Расположение точек на поверхности сферы, при котором они максимально удалены друг от друга.
В оптимальной конфигурации ядер два заряда находятся на концах диаметра, три заряда образуют правильный треугольник, четыре — тетраэдр, шесть — октаэдр. Эти конфигурации можно сделать более наглядными, если представить электронные пары в виде связки воздушных шаров, как показано на рисунке.

Связки, содержащие от двух до шести шаров, максимально удалённых друг от друга.
МОЛЕКУЛЫ, КОТОРЫЕ СУЩЕСТВУЮТ ТОЛЬКО В ВОЗБУЖДЁННОМ СОСТОЯНИИ Если сближать друг с другом два атома гелия (электронная конфигурация 1s2),… Если же один из атомов возбудить и перевести 1s-электрон на 2s-ypoвень, то такой атом способен соединиться с…Силы, действующие в молекулярном ионе H+2 при его образовании из атомов.
Следует заметить, что истинные заряды на атомах почти всегда меньше эффективных. Так, в молекуле НС1 эффективные заряды атомов Н и Сl равны +1 и… ПОЧЕМУ ОБРАЗУЮТСЯ ХИМИЧЕСКИЕ СВЯЗИ? Рассмотрим образование простейшего молекулярного иона H+2; Н+Н+ ® H+2.Поверхности равной электронной плотности молекулы этилена С2Н4: 1 — 0,002; 2 — 0,2; 3 — 0,36.
Во-вторых, карты электронной плотности отражают изменение распределения электронов при образовании химической связи из атомов. Чтобы составить… В-третьих, распределение электронной плотности показывает, к какому из… Наконец, форма уровней электронной плотности даёт представление о геометрии молекул, которое дополняет информацию,…Контурная карта. Максимумы электронной плотности сосредоточены
На атомах углерода и водорода.
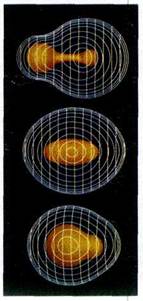
Поверхности равной электронной плотности молекул LiH, H2, HF.
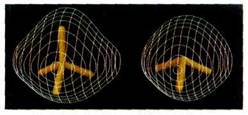
Электронные облака молекул метана СН4 и аммиака NH3.
Для описания электронов в атоме используют понятие атомной орбитали (АО), которая характеризует вероятность нахождения электрона в каждой точке… В отличие от изолированных атомов, в молекулах электроны притягиваются сразу…Электроны, проводящие большую часть времени между ядрами, связывают их друг с другом. Электроны, находящиеся за ядрами, стремятся их раздвинуть (этот эффект называют разрыхлением).
ЧТО ТАКОЕ ВАЛЕНТНОСТЬ
Понятие валентности в химии долго считалось одним из основных. «Валентность — фундаментальное свойство атома, — писал более века назад знаменитый немецкий учёный, один из создателей теории химического строения Фридрих Кекуле, — свойство такое же постоянное и неизменяемое, как и самый атомный вес». Однако в современной научной литературе этот термин употребляется не очень широко. Более того, даже в учебниках он трактуется по-разному.
Так, если валентность определять общим числом электронов, участвующих в образовании химических связей с другими атомами, то азот в HNO3 следует считать пятивалентным, поскольку его атом использовал все свои пять внешних электронов — два s-электрона (спаренные) и три р-электрона (неспаренные):
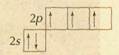
Если же валентность определять числом электронных пар, которыми данный атом связан с другими, то максимальная валентность азота будет равна четырём.
При этом три р-электрона образуют с электронами других атомов три ковалентные связи, а ещё одна образуется за счёт двух s-электронов. Пример — реакция аммиака с кислотами.
Наконец, если определять валентность только числом неспаренных электронов в атоме, то валентность азота не может превышать трёх, поскольку распаривание s-электронов невозможно — для этого у атома азота нет подходящих орбиталей. Например, в галогенидах азот образует только три ковалентные связи, и не существует таких соединений, как NCl5, или NBr5 (в отличие от вполне стабильных РСl5 и РВr5).
Если же атом азота отдаст один из своих s-электронов, то в образовавшемся катионе N+ останется четыре неспаренных электрона и его валентность будет равна четырём. Так происходит в молекуле HNO3, где один электрон переходит от атома азота к атому кислорода.
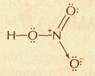
Как видим, разные определения валентности приводят к разным результатам даже в случае простых молекул.
Почему так происходит? Можно ли однозначно определить валентность? Чтобы найти ответы на эти вопросы, рассмотрим, как с развитием химии изменялось само это понятие.
Впервые идею об определённой «ёмкости насыщения» атомов металлов и кислорода высказал в 1853 г. английский химик Эдуард Франкленд (1825— 1899). К концу 50-х гг. XIX в. большинство химиков признавали, что валентность (тогда говорили «атомность») углерода равна четырём, кислорода и серы — двум, галогенов — единице. Сам термин «валентность», предложенный в 1868 г. берлинским профессором Карлом Вихельхаусом (1842—1927), был взят из латыни (от лат. valentia — «сила»), однако длительное время почти не употреблялся. В классическом труде «Основы химии» Д. И. Менделеев лишь несколько раз использует как синоним валентности понятие «атомность», не останавливаясь на нём детально и не давая однозначного определения.
И это не случайно. «Ни одно понятие в химии не получало такого количества неясных и неточных определений, как понятие валентности», — писал в 1917 г. американский педагог Александр Смит. Вначале химики ошибочно полагали, что каждый элемент имеет одну валентность. Это неминуемо приво-
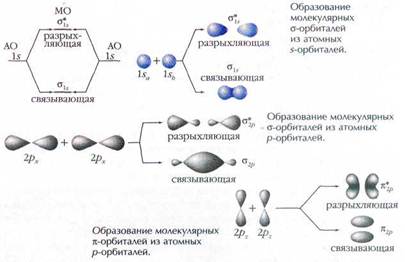
ложения ядер, т. е. от геометрии молекулы. При образовании молекулы из атомов электронные облака атомов перекрываются, атомные орбитали «перемешиваются», и из них получаются новые, молекулярные орбитали. Например, когда молекула образуется из двух одинаковых атомов, при перекрывании двух атомных s-opбиталей возникают две МО: одна из них имеет меньшую энергию, чем атомная, а другая — большую. Первую орбиталь называют связывающей, а вторую — разрыхляющей (её обозначают звёздочкой). Наличие электрона на связывающей орбитали приводит к упрочению химической связи, а на разрыхляющей — к ослаблению её, вплоть до полного разрыва. На связывающей орбитали электронная
дило к искажению химических формул, которые просто «подгоняли» к такому допущению. В частности, формулы двух известных хлоридов меди записывали так: Cl—Cu—Cu—Cl и Cl—Cu—Cl. По этому поводу Смит делает важный и актуальный во все времена вывод: «Вполне противно научному методу — изобретать или искажать факты в целях поддержки представления, которое, не будучи основано на опыте, является результатом простого предположения. Однако история науки показывает, что подобные ошибки наблюдаются часто».
Обзор представлений начала XX в. о валентности дал в 1912 г. известный русский химик Лев Александрович Чугаев (1873—1922). Он отметил, что термин потерял однозначность и первоначальную простоту определения и фактически, по мере развития химии, разделился на несколько понятий — парциальную валентность, главную и побочную и т. д.
Первые осложнения начались с признания, что валентность — величина переменная. Теорию немецкого химика Фридриха Карла Иоганнеса Тиле (1865—1918) о парциальных, или частичных, валентностях (см. статью «Ароматический — не значит ароматный») Чугаев считает одной из первых попы-
ток расширить классическое понятие валентности. Швейцарский химик Альфред Вернер предположил, что наряду с главными, или основными, единицами валентности существуют другие, побочные. Например, в соединении СоСl3•6NH3 атом кобальта связан одновременно с девятью атомами хлора и азота!
Чугаев коснулся также теории немецкого химика Рихарда Абегга (1869— 1910) об электровалентности, которая может быть положительной (в высших кислородных соединениях) или отрицательной (в соединениях с водородом). Валентность при этом определяется числом отдаваемых или принимаемых в реакции электронов.
Обзор Чугаева заканчивается упоминанием химических соединений, к которым понятие валентности вообще неприменимо. К ним относятся, например, интерметаллические соединения: NaCd5, NaZn12, FeZn7 и др.
Можно привести и другие факты, которые стали известны значительно позже. Так, в озоне пара электронов удерживает не два, а три атома кислорода; в других же молекулах химическая связь может осуществляться вообще единственным электроном. Описать подобные связи без привлечения аппарата квантовой химии невозможно.
И эти «неклассические» случаи вовсе не исключение. Как, например, определить валентность атомов водорода и бора в пентаборане В5Н9, в котором некоторые атомы водорода связаны сразу с двумя атомами бора? Какова валентность железа в пентакарбониле Fe(CO)5 (атом железа связан с пятью атомами углерода) или хрома — в пентакарбонилхромате натрия Na2Cr(CO)5? Подобных «нарушителей валентности» становилось всё больше. Возникшие трудности привели к тому, что химики вместо понятия валентности всё шире стали использовать чисто формальное понятие степени окисления.
Какие же напрашиваются выводы? По-видимому, традиционное понятие валентности имеет чёткий и однозначный смысл только для соединений, в которых все химические связи являются двухцентровыми (т. е. соединяют только два атома) и каждая связь осуществляется парой электронов, расположенной между двумя соседними атомами, проще говоря — для ковалентных соединений типа HCl, СО2, С5Н12 и т. п. Попытки же дать определение валентности «на все случаи жизни» малопродуктивны и вряд ли нужны. Фактически этот термин стал абстракцией. Недаром авторы многих современных учебников обходятся без него.
ХИМИЧЕСКАЯ СВЯЗЬ В МЕТАЛЛАХ — СУММА 1023 АТОМНЫХ ОРБИТАЛЕЙ
Аля металлов характерен особый тип химической связи: валентные электроны всех атомов объединяются в так называемый электронный газ и свободно двигаются в кристаллической решётке, образованной ионами. Каждый электрон как бы принадлежит всем атомам одновременно, и кристалл металла можно рассматривать как одну гигантскую молекулу. В таких молекулах МО имеют особые свойства.
Рассмотрим кусок лития массой 1,17 г. Он содержит 1/6 моль лития, т. е. 1023 атомов, каждый из которых имеет наполовину заполненную валентную 2s-орбиталь. Все 1023 атомных орбиталей в молекуле превращаются в 1023 молекулярных орбиталей, энергия которых изменяется в пределах 100 кДж/моль, а сами орбитали распределены (делокализованы) по всей молекуле. Хорошая электрическая проводимость металлов объясняется тем, что разница в энергии между двумя соседними МО составляет ничтожно малую величину: 100/1023=10-21 кДж/моль. Поэтому электроны могут свободно переходить с орбитали на орбиталь при наличии внешнего электрического поля.
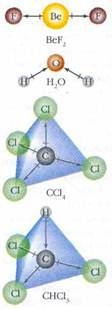
В изображённых молекулах каждая связь полярна. Стрелками отмечено направление смешения электронной плотности, а штрихами на связях — точки, в которых заряд равен нулю. Молекулы BeF2 и CCl4 неполярны — в них связи (стрелки) взаимно компенсируются. В полярных молекулах Н2O и CHCl3 такой компенсации нет.
плотность сосредоточена между атомами, на разрыхляющей — за ними. Перекрываются s-орбитали всегда по линии, соединяющей ядра атомов. Возникающие при этом МО обозначают буквой s, а соответствующую химическую связь называют s-связью.
У одинаковых атомов p-орбитали могут перекрываться как по линии, соединяющей ядра, так и вне этой линии. В последнем случае образующиеся МО обозначают буквой p, а такую химическую связь называют p-связью.
Молекулярные орбитали гораздо чаще связывают разные атомы, чем одинаковые. При этом также образуются связывающие и разрыхляющие орбитали. Например, в молекуле HF две s-орбитали образуются при перекрывании 1s-орбитали атома Н и одной из 2р-орбиталей атома F. Два электрона (по одному от каждого атома) занимают связывающую орбиталь, а разрыхляющая орбиталь остаётся свободной. Остальные восемь электронов атома F не принимают участия в образовании химической связи.
Мы изобразили только несколько простейших типов МО. Современные компьютеры позволяют рассчитывать МО и электронную плотность в сложных молекулах, содержащих десятки атомов. В них могут существовать орбитали, связывающие между собой несколько атомов. Такие орбитали называют многоцентровыми. А в металлах МО связывают сразу все атомы; химическая связь в них так и называется — металлическая.
СВЯЗИ МЕЖДУ МОЛЕКУЛАМИ
Основных типов химических связей три — ковалентная, ионная и металлическая. Но иногда важную роль могут играть довольно слабые силы, действующие между молекулами. Этими силами в основном определяются температуры плавления и кипения веществ, а также некоторые их химические свойства.
Все молекулы электрически нейтральны. Однако во многих из них центры отрицательных и положительных зарядов находятся в разных местах. В таких случаях молекулу называют диполем. Полярные молекулы легко притягиваются друг к другу.
Правда, взаимодействие диполей относительно слабое: его энергия обратно пропорциональна шестой степени расстояния между центрами молекул Е~ 1/r6 (для сравнения: энергия кулоновского взаимодействия Е~1/r). Поэтому оно проявляется главным образом в твёрдом и жидком состояниях, когда расстояния между молекулами намного меньше, чем в газе. В твёрдом состоянии молекулярные диполи ориентированы так, что положительные полюса одних максимально приближены к отрицательным полюсам других.
В отличие от полярных молекул, в неполярных разделения зарядов нет, и электронная плотность распределена более или менее равномерно. Однако внутри молекулы из-за флуктуаций (колебаний) электронной плотности могут возникать и исчезать частичные заряды, которые порождают такие же заряды в соседних молекулах. Благодаря появлению таких «мгновенных диполей» между ними возникает притяжение или отталкивание. Это взаимодействие называется индукцион-
ным или дисперсионным. Оно существует между любыми молекулами. Его энергия обратно пропорциональна шестой степени расстояния (Е~ 1/r6) и увеличивается с ростом молекулярной массы. Так, дисперсионное взаимодействие между молекулами галогенов быстро убывает в ряду I2 — Вr2 — Сl2. Молекулы иода при комнатной температуре прочно связаны друг с другом и образуют твёрдое вещество, в броме они взаимодействуют слабее, а в хлоре ещё слабее, поэтому бром — жидкость, а хлор — газ.
Большой вклад в создание теории диполь-дипольного и дисперсионного взаимодействий внёс нидерландский физик Йоханнес Дидерик Ван-дер-Ваальс; в честь него эти взаимодействия были названы вандерваальсовыми.
Между некоторыми молекулами может образоваться более сильная связь. Так бывает, когда молекула содержит атом водорода, соединённый ковалентной связью с атомом фтора, кислорода или азота. Любой из этих атомов оттягивает электронную плотность связи на себя и приобретает частичный отрицательный заряд, сообщая атому водорода равный по величине положительный заряд.
В результате положительно заряженный атом водорода одной молекулы притягивается к отрицательно заряженному атому фтора, кислорода или азота другой молекулы. Это притяжение имеет частично электростатический (кулоновский), частично ковалентный характер. Такую связь называют водородной.
Водородная связь прочнее вандерваальсовой, но обычно намного слабее ковалентной связи. Она играет огромную роль в природе. Именно водородная связь отвечает за структуру воды, льда, белков, нуклеиновых кислот. Благодаря водородным связям в жидкой воде и даже в парах воды существуют устойчивые молекулярные ансамбли, содержащие десятки молекул Н2О. В 1991 г. в парах воды были обнаружены частицы, в которых ион Н3О+ окружён двадцатью (!) молекулами Н2О, соединёнными между собой водородными связями.
СВОЙСТВА ХИМИЧЕСКИХ СВЯЗЕЙ
Чтобы можно было сравнивать друг с другом химические связи, в том числе и связи разных типов, используют единые количественные характеристики, среди которых главные — длина, энергия, полярность и порядок связи.
Длина связи — это равновесное расстояние между ядрами атомов, со-
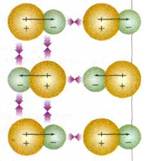
Дипольные взаимодействия в молекулярном кристалле.
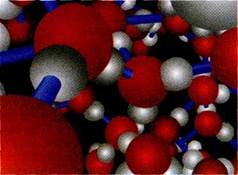
Сеть водородных связей в воле. Красные кружки — атомы кислорода, белые — атомы водорода, синие линии обозначают водородные связи.
ИОННАЯ СВЯЗЬ Ионная связь возникает при электростатическом притяжении положительно и… Этот тип связи реализуется во многих кристаллических веществах — щелочах (К+ОН-), соляхОбразование водородной связи между молекулами воды.
Прочность химической связи определяется энергией связи, т. е. энергией, которая необходима для того, чтобы разорвать связь и развести атомы на… Полярность связи показывает, насколько электронная плотность смещена к одному… Порядок (или, иначе, кратность) связи в различных теориях химической связи определяют по-разному. В теории…Кристаллическая структура сфалерита ZnS.
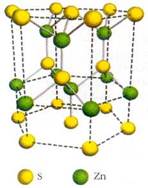
Кристаллическая структура вюрцита ZnS.
Известна и другая модификация углерода с гомодесмической структурой — так называемый гексагональный алмаз, или лонсдейлит. Здесь каждый атом… Полиморфизм свойствен и химическим соединениям. Если в структурах алмаза и… Если же на серединах отрезков, изображающих ковалентные связи в кристаллах алмаза и лонсдейлита, расположить…Кристаллические структуры различных модификаций SiO2: 1 — кристобалит 2 — тридимит, 3 — кварц.
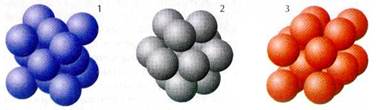
Основные типы кристаллических решёток металлов в виде шаровых упаковок: 1 — медь, 2 — магний, 3 — железо.
Выращивают кристаллы разными способами. Например, охлаждая насыщенный раствор. С понижением температуры растворимость большинства веществ… Другой метод выращивания кристаллов — постепенное удаление воды из насыщенного раствора. И в этом случае чем медленнее удаляется вода, тем лучше получаются кристаллы. Можно оставить…Монокристалл хромокалиевых квасцов.
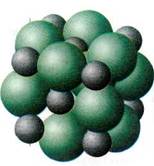
Шаровая упаковка хлорида натрия NaCl.
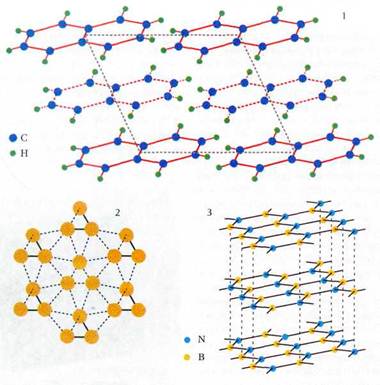
Кристаллические структуры нафталина С10Н8 (1), серого селена (2) и нитрила бора BN (3).
Совсем иной вид имеют структуры кристаллов, построенных из молекул. К их числу относятся некоторые не- органические (Cl2,I2, P4, S8) и все органические вещества, кроме полимеров.… Бывает и так, что атомы, соединённые химическими связями, образуют бесконечную цепь, бесконечный слой или бесконечный…МЕТАМОРФОЗЫ ВЕЩЕСТВА
ФИЗИЧЕСКИЙ ПРОЦЕСС И ХИМИЧЕСКАЯ РЕАКЦИЯ
Изменения веществ и тел обычно подразделяют на два типа: физические процессы и химические превращения (реакции). Физический процесс не затрагивает молекул (или других мельчайших структурных… это физические процессы. При этом молекулы воды не распадаются на атомы, атомы алюминия не объединяются в молекулы. …В химической реакции происходит перераспределение химических связей: старые — рвутся, новые — образуются.

Образование инея — пример физического процесса.
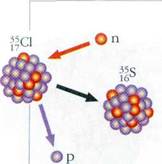
В ядерной реакции, в отличие от химической, происходит изменение зарядов ядер атомов: 3517Cl+10n®3516S+11p.

Выделение газа может
Сопровождать
Не только химическую
Реакцию.
При химических реакциях строение атомов всегда остаётся неизменным. В этом главное отличие химических процессов от ядерных, в ходе которых ядра… Химические превращения записывают с помощью уравнений. Вещества,… КАК РАСПОЗНАТЬ ХИМИЧЕСКУЮ РЕАКЦИЮИзменение окраски вещества возможно и при простом механическом воздействии на него. Жёлтый и красный оксид ртути HgO различается лишь размером частиц.

Существуют вещества, цвет которых зависит от температуры. К ним
относятся, например, тетраиодомеркураты меди(1) Cu2[Hgl4)
И серебра(1) Ag2[HgI4], используемые в качестве термокрасок.
Окраска этих веществ изменяется, если их поместить в горячую
Воду.
по цвету которых можно ориентировочно определить температуру среды.
КАКИЕ БЫВАЮТ РЕАКЦИИ
Простейшие химические реакции обычно подразделяют на четыре типа: реакции соединения, разложения, замещения и обмена. Д. И. Менделеев определял соединение как реакцию, «при которой из двух веществ происходит одно, или, вообще, из данного числа — меньшее их число». Например, при нагревании порошков железа и серы образуется сульфид железа: Fe+S=FeS. К реакциям соединения относят процессы горения простых веществ (серы, фосфора, углерода) на воздухе: С+О2=СО2. Они всегда сопровождаются выделением тепла — являются экзотермическими (см. статью «Тепло химических реакций»).
Реакции разложения, по Менделееву, «составляют случаи, обратные соединению, то есть такие, при которых одно вещество даёт два, или, вообще, данное число веществ — большее их число. Так, при накаливании дерева (без доступа воздуха. — Прим. ред.) получается горючий газ, водянистая жидкость, смола или дёготь и уголь». Более простой пример — разложение
МЕХАНОХИМИЯ
Обычно считается, что измельчение вещества — физический процесс. Однако это не совсем так. При длительной обработке в специальных мельницах частицы вещества за счёт поглощения энергии переходят в химически активное состояние: усиливаются колебательные движения атомов, молекул и ионов в узлах кристаллической решётки, ослабляются связи между ними, рвутся некоторые связи, возникают свободные радикалы.

Этот процесс учёные называют механохимической активацией, а область химии, изучающую химические и физико-химические изменения веществ под действием механической энергии, — механохимией.
Активированное вещество вступает в химические реакции намного легче, чем не прошедшее механохимической обработки. Многие металлы (железо, алюминий) после измельчения становятся пирофорными (от греч. «пир» — «огонь» и «форос» — «несущий») — воспламеняются на воздухе.
Механохимической активации подвергают удобрения, а также некоторые лекарственные препараты (аспирин), ведь активированное вещество быстрее переходит в раствор, полнее усваивается организмом.
Инициирование некоторых химических реакций ударом или трением применяется и в лабораториях (взрыв смеси бертолетовой соли с фосфором), и в быту (бензин в зажигалке воспламеняется от искры, полученной трением кремня).
известняка: СаСО3=СаО+СО2. Для проведения реакции разложения, как правило, требуется нагревание. Такие процессы — эндотермические, т. е. протекают с поглощением теплоты.
В реакциях двух других типов число реагентов равно числу продуктов (Менделеев называл их реакциями перемещения). Если взаимодействуют простое вещество и сложное — это реакция замещения: Fe+CuSO4= FeSO4+Cu.
Реакции между двумя сложными веществами, при которых они обмениваются своими частями, относят к реакциям обмена. Большое их число протекает в водных растворах. Типичный пример — нейтрализация кислоты щёлочью: NaOH+HCl=NaCl+Н2О.
Однако очень многие реакции не укладываются в приведённую простую схему. В частности, реакция между перманганатом калия и иодидом натрия не может быть отнесена ни к одному из указанных типов:
2KMnO4+10NaI+8H2SO4=2MnSO4+K2SO4+5Na2SO4+5I2+8H2O.
Такие сложные уравнения представляют собой лишь суммарную запись процесса, но не отражают того, через какие стадии он проходит, какие промежуточные вещества при этом образуются.
Иногда все химические превращения подразделяют на два типа — окислительно-восстановительные, при которых изменяется степень окисления атомов некоторых элементов (см. статью «Окисление или восстановление?»), и реакции, протекающие без изменения степеней окисления.
Что касается органической химии, то в ней принята своя классификация химических реакций.

Горение любого топлива — типичный пример окислительно-восстановительного процесса.
ОКИСЛЕНИЕ ИЛИ ВОССТАНОВЛЕНИЕ?
Первую химическую реакцию человек провёл тогда, когда научился добывать огонь. С той поры и до настоящего времени реакции горения играют первостепенную роль в нашей жизни. Они приносят в дома тепло, двигают автомобили, самолёты и ракеты, помогают извлекать ценные вещества из природного сырья.
Флогистонная теория Шталя впервые выделила процессы горения и прокаливания металлов в отдельную группу реакций (см. статью «Химия в XVIII веке»). Кислородная теория горения, предложенная Лавуазье, обобщила экспериментальный материал, накопленный в «эпоху флогистона». А кроме того, Лавуазье выдвинул кислородную теорию кислот: он полагал, что своими свойствами кислоты обязаны присутствию в них кислорода (отсюда и название элемента oxygenium — «рождающий кислоты»). Поэтому реакции горения веществ на воздухе стали называть окислением, а
процессы, обратные окислению, т. е. связанные с уменьшением количества кислорода в веществе, — раскислением или восстановлением. Поскольку в ходе окислительных реакций вещество нередко разрушается (как, например, при ржавлении), термин «восстановление» указывает на процесс, противоположный окислению.
В дальнейшем представления о сущности процесса окисления значительно расширились. Как показали эксперименты, многие вещества (водород, металлы) горят не только в кислороде, но и в хлоре, броме. А значит, окисление — это не только присоединение кислорода. В 1914 г. русский учёный Лев Владимирович Писаржевский (1874—1938) предложил электронно-ионную теорию окислительно-восстановительных реакций.
В наши дни химикам известны тысячи самых разных окислительно-восстановительных реакций, в том числе и протекающих в живых орга-
КАКИЕ БЫВАЮТ ОКИСЛИТЕЛИ И ВОССТАНОВИТЕЛИ
Самый распространённый на Земле окислитель — кислород. Намного более сильным окислителем является озон О3 — аллотропная модификация кислорода. Он способен окислять многие вещества, которые с кислородом при обычных условиях не реагируют, например оксид азота(1/): 2NO2+О3= N2O5+O2 и серебро: 2Ag+2О3=Ag2O2+2О2.
Наиболее сильный окислитель из числа простых веществ — фтор. Но он слишком активен, и его трудно получить в свободном виде. Поэтому в лабораториях в качестве окислителя используют перманганат калия KMnO4. Его окислительная способность зависит от концентрации раствора, температуры и характера среды. Кроме него применяют также дихромат калия К2Сг2О7, азотную кислоту HNO3, пероксид водорода Н2О2, хлор С12, гипохлорит натрия NaClO. Очень сильные окислители — фториды благородных газов. Самый сильный из известных окислителей — фторид кислорода OF2.
Из восстановителей наиболее распространённый в природе — углерод. Его широко используют в промышленности для получения металлов из оксидов: Fe2O3+3С=2Fe+3СО; ZnO+С=Zn+CO.
Другой широко распространённый восстановитель — водород. Как и углерод, при нагревании он лег-
ко отнимает атомы кислорода у многих оксидов, превращаясь при этом в воду: СuО+Н2=Сu+Н2О; WO3+ЗН2=W+ЗН2О.
Очень сильными восстановителями являются щелочные и щёлочно-земельные металлы, алюминий. Они восстанавливают даже воду, вытесняя из неё водород: 2Na+2Н2О=2NaOH+Н2.
На практике восстановительными свойствами металлов пользуются для получения некоторых активных металлов из их оксидов и хлоридов. Так получают барий: ЗВаО+2Al=ЗВа+Аl2О3, стронций: 3SrO+2Al=3Sr + Al2O3, титан: TiCl4+2Mg=Ti+2MgCl2.
В лабораторных условиях восстановителями служат соединения, содержащие элементы в низких степенях окисления: сероводород H2S (S-2), иодоводородная кислота HI (I-), хлорид олова(II) SnCl2 (Sn+2). В органическом синтезе для восстановления обычно используют комплексные гидриды металлов: алюмогидрид лития LiAlH4 и борогидрид натрия NaBH4; они содержат водород в степени окисления -1.
Самый слабый восстановитель— фторид-ион F-. Окислить его до свободного фтора можно только с помощью электролиза или экзотических окислителей. Это объясняется с помощью теории сопряжённых окислителей и восстановителей.
При горении магниевой ленты на воздухе электроны от атомов магния переходят к атомам кислорода: 2Mg+О2=2MgO.
низмах. Можно с уверенностью говорить: химия жизни — это процессы окисления-восстановления. ЧТО ЖЕ ТАМ ПРОИСХОДИТ? В ходе химических превращений одни химические связи разрываются, а другие образуются, при этом во многих случаях…Горение красного фосфора в кислороде протекает очень интенсивно. За несколько секунд белый дым заполняет всю колбу. После окончания реакции на дне и стенках сосуда оседают мельчайшие кристаллики оксида фосфора(/).

В процессе окислительно-восстановительной реакции окислитель восстанавливается, а восстановитель окисляется.
Окисление — это процесс потери атомом или ионом электронов. Обратный процесс присоединения электронов называется восстановлением. Элемент, который… Любая окислительно-восстановительная реакция состоит из двух процессов, или… Окислитель и восстановитель, участвующие в одной полуреакции, называют сопряжёнными. Например, реакция замещения…До проведения реакции о составе её продуктов часто остаётся только гадать...

Растворы ферроина и бромата калия до (слева) и после (справа) прибавления серной кислоты.
Наконец, определяют, в виде каких соединений продукты реакции существуют в данных условиях — в кислой, щелочной или нейтральной среде (см. статью… Пользуясь этими рецептами, составим уравнение реакции между сульфатом… FeSO4+H[AuCl4] ®?ЕГО ВЕЛИЧЕСТВО РАСТВОР
Можно привести ещё множество подобных примеров, подтверждающих справедливость старинного изречения. Подсчитано, что современные химики более 99 %…Всем, кто пьёт сладкий чай, известно, какой замечательной растворимостью в горячей воде обладает сахар.
Химикам-аналитикам хорошо известно, что вода немного растворяет даже стекло. Если растирать в ступке порошок стекла с водой, то в присутствии… Вот почему так трудно получить абсолютно чистую воду, которая необходима для… НАБЛЮДАЮ ХОЛОД И КИПЕНИЕРастворимость солей и щелочей в воде в зависимости от температуры.
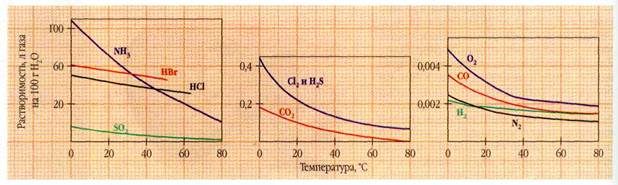
Растворимость газов в воде при атмосферном давлении в зависимости от температуры.
понижение температуры замерзания DТз раствора не зависит от химической природы растворённого вещества, а зависит только от его концентрации:… Метод криоскопии очень помог учёным в распознавании структуры новых… (1859—1927), в которой проводили тысячи криоскопических определений, бытовала шутка: «В Европе снова наступил…Растворённые в океанской воде соли понижают температуру плавления льда.
В популярных книгах по ботанике описывается такой эксперимент. В широкой части моркови нужно высверлить отверстие вдоль её оси, вставить туда… Впервые явление осмоса наблюдал французский естествоиспытатель аббат Жан… создала в нём такое давление, что пузырь раздулся и лопнул. После Нолле проводилось много подобных экспериментов. Они…Сванте Август Аррениус.
Спор между сторонниками и противниками Аррениуса продолжался не один год. И, как это часто бывает в науке, в ожесточённом споре между приверженцами…Растворение нитрата аммония сопровождается заметным поглощением
Тепла. Смоченный водой стаканчик с раствором примерзает к деревянной скамейке так прочно, что её можно оторвать от стола.
РАСТВОР — НЕ МЕХАНИЧЕСКАЯ СМЕСЬ!
То, что при образовании растворов молекулы растворителя и растворённого вещества не просто перемешиваются, можно продемонстрировать многими опытами. Например, раствор иода в бензине, ССl4 и других так называемых инертных растворителях имеет фиолетовый цвет — точно такой же, как у паров иода. Раствор же в бензоле, спирте и ряде других растворителей — коричневого цвета (как иодная настойка), в водном растворе поливинилового спирта [—СН2—СН(ОН)—]n — ярко-синего (этот раствор применяют в медицине в качестве дезинфицирующего средства под названием «иодинол»). И вот что любопытно: реакционная способность иода в «разноцветных» растворах неодинакова. Так, в коричневых растворах иод намного активнее, чем в фиолетовых, например быстрее реагирует с медью. Это объясняется тем, что молекулы иода могут взаимодействовать с молекулами растворителя, образуя комплексы, в которых иод более активен.
Иод — далеко не единственное вещество, меняющее свою реакционную способность под влиянием растворителя. Так, растворы серы в сероуглероде CS2, бензоле С6Н6 и пиридине C5H5N с различной скоростью взаимодействуют с ртутью и серебром (в ходе реакции образуются сульфиды Ag2S и HgS). To есть растворитель не просто инертная среда, позволяющая молекулам (и, как потом оказалось, ионам тоже) свободно двигаться и сталкиваться между собой: порой он может активно вмешиваться в ход химической реакции.
для LiF, 2240 кДж/моль для СаСl2 и т. д. Если суммарная энергия гидратации катионов и анионов при образовании раствора больше энергии кристаллической решётки, то растворение будет сопровождаться нагреванием, а если меньше — охлаждением раствора. Именно поэтому при растворении в воде таких веществ, как LiCl, безводный СаСl2,и многих других раствор нагревается, а при растворении КСl,

Растворы иода в воде, этаноле, бензоле и четырёххлористом углероде.
В разбавленных растворах плохо растворимых солей устанавливается равновесие между твёрдым кристаллическим осадком и ионами в растворе: часть… Если резко уменьшить концентрацию катионов или анионов над осадком, то он…Осадки хлорида, бромида и иодида серебра.
Эти рассуждения можно проиллюстрировать эффектной цепочкой превращений, в которых участвуют ионы серебра. Выпишем значения ПР типичных… Уже первое вещество — Ag2CO3 в воде практически не растворяется. Но если добавить к бесцветному раствору над…Каждый ион в водном растворе окружён плотной «гидратной шубой». Cuльнее всего из неорганических ионов гидратируется Н+, образуя ионы Н3О+, Н5О+2, Н9О4+ и т. д.
*Растворимости солей в воде и в жидком аммиаке сильно различаются. В 100 г жидкого NH3 при 25 °С может быть растворено:
NH4NO3 389,6 г.
NaNO3 97,6 г,
KNO3 10,4 г,
NaCl 3,0 г,
NaI 161,9 г,
NaF 0,35 г.
– Конец работы –
Используемые теги: устройство, вещества0.053
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: УСТРОЙСТВО ВЕЩЕСТВА
Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов