Фридрих Август Кекуле.
Основные понятия химии — «атом» и «молекула». Атомов известно лишь немногим более 100 видов, а вот молекул — свыше 18 млн. Столь богатое разнообразие обусловлено тем, что атомы разных элементов, взаимодействуя друг с другом, способны объединяться в молекулы, причём молекулы могут содержать разное число атомов одного вида. К этому выводу учёные пришли ещё в первой половине XIX в. Шотландский химик Арчибальд Купер (1831 — 1892) и немецкий химик Фридрих Август Кекуле (1829—1896) практически одновременно, в 1858 г., предложили изображать связи между атомами в виде чёрточек. Так появились структурные формулы молекул, показывающие, в каком порядке разные атомы связаны друг с другом.
Важное открытие, касающееся химической связи, принадлежит нидерландскому химику Якобу Вант-Гоффу. Он доказал, что четыре связи атома углерода в органических соединениях направлены к вершинам тетраэдра, в центре которого находится сам атом. Это означало, что химические связи имеют жёсткую направленность, а молекулы характеризуются определённой геометрической формой. Швейцарский химик Альфред Вернер (1866—1919) распространил данный вывод и на неорганические молекулы, создав теорию строения комплексных соединений.
Несмотря на многие гениальные догадки о строении молекул, природа связи между атомами оставалась загадкой до тех пор, пока за дело не взялись физики. В 1897 г. английский учёный Джозеф Джон Томсон (1856—1940) открыл электрон и сразу понял: эта частица может играть ключевую роль в образовании химической связи. В той же статье, в которой сообщалось об открытии электрона, Томсон предположил, что между атомами в молекуле действуют электрические силы, причём один конец химической связи имеет положительный заряд, а другой — отрицательный. Идея оказалась очень плодотворной и легла в основу всех последующих теорий химической связи.
ТЕОРИЯ ЛЬЮИСА, ИЛИ ЭЛЕКТРОННЫЙ «КОЛХОЗ»
Классическую электронную теорию химической связи предложил в 1916 г. американский химик Гилберт Ньютон Льюис (1875—1946). Как уже было известно, завершённые электронные оболочки атомов благородных газов отличаются особенной устойчивостью. Льюис предположил, что при образовании химической связи возникают пары электронов, которые принадлежат сразу двум атомам. Тем самым атомы заполняют до конца свой внешний электронный уровень и приобретают электронную конфигурацию благородного газа. Льюис назвал это правилам октета, так как атомы всех благородных газов (кроме гелия) имеют на внешнем уровне восемь электронов. С помощью правила октета удалось объяснить электронное строение огромного числа соединений. А связь, образованная за счёт общей пары электронов, получила название ковалентной.
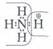
Для обозначения электронов Льюис использовал точки: Н:Н. Но часто общую пару электронов изображают просто чёрточкой, которая и символизирует химическую связь: Н—Н. В молекуле Н2 каждому атому принадлежат два электрона (конфигурация атома гелия), которые предоставлены в общее пользование двумя атомами водорода (это обменный механизм образования ковалентной связи).
Подобным образом устроена и молекула F2. У атома фтора на внешнем уровне семь электронов — чтобы достичь электронной конфигурации неона не хватает одного. Поэтому каждый атом F отдаёт по одному электрону в общее пользование:
Теперь оба атома имеют на внешнем уровне по восемь электронов (октет), из которых два общих, а шесть (три пары) сохраняются в индивидуальном пользовании.
Аналогично образуются и кратные связи. Так, тройная связь в молекуле N2 (NºN) возникает в результате создания трёх общих электронных пар.
В двухатомных молекулах простых веществ (Н2, F2, N2 и др.) общие пары электронов в равной степени принадлежат обоим атомам. Такая связь называется непопярной. При образовании ковалентной связи в молекулах сложных веществ общая электронная пара оказывается смещённой в сторону одного из атомов. Молекула при этом поляризуется: одна её часть несёт частичный положительный заряд (8+), а другая — отрицательный (8-). Примером может служить молекула HF, в которой атом Н достигает электронной конфигурации гелия, а атом F — неона:
Общая электронная пара в этом соединении смещена в сторону атома фтора. Это пример полярной связи.
Бывает, что один из атомов (донор электронов) предоставляет в общее пользование два электрона, а другой (акцептор) — ни одного. Такой механизм образования ковалентной связи называют донорно-акцепторным (иногда эту связь обозначают стрелкой, направленой к акцептору).
Пример — ион аммония. Атом азота имеет три неспаренных электрона, которые участвуют в трёх ковалентных связях с тремя атомами водорода. Кроме того, у атома азота есть ещё одна пара электронов. При присоединении иона Н+ к аммиаку NH3 эта пара поступает в совместное пользование атомов азота и водорода. В данном случае атом азота выступает в качестве донора, а Н+ — акцептора электронной пары:
ЧЕМ ДАЛЬШЕ ДРУГ ОТ ДРУГА, ТЕМ ЛУЧШЕ. ВЛИЯНИЕ ЭЛЕКТРОННЫХ ПАР НА ГЕОМЕТРИЮ МОЛЕКУЛ
В 1957 г. канадский физикохимик Роналд Джеймс Гиллеспи создал простую, но красивую теорию, которая позволяет с хорошей точностью по структуре Льюиса предсказывать геометрическую форму молекул.
Согласно этой теории, во многих простых молекулах химические связи расположены таким образом, что электронные пары, принадлежащие одному атому, максимально удалены друг от друга.
Например, в молекуле ВеН2 атом бериллия делит с атомами водорода две пары электронов. Одна пара максимально удалена от другой, когда угол между связями составляет 180°. Это означает, что молекула линейна.
Теория даёт возможность установить геометрическое строение молекул типа AXnEm, где к центральному атому А присоединены n атомов X и имеется также т неподелённых электронных пар (что обозначено символом Еm). Общее число электронных пар m+n составляет от двух до восьми.
Чтобы определить максимально удалённое расположение электронных пар, можно представить каждую пару точечным зарядом на поверхности сферы, в центре которой находится атом, и найти максимум суммы расстояний между этими зарядами.