Поверхности равной электронной плотности молекулы этилена С2Н4: 1 — 0,002; 2 — 0,2; 3 — 0,36.
поэтому она отражает размеры и форму электронного облака.
Во-вторых, карты электронной плотности отражают изменение распределения электронов при образовании химической связи из атомов. Чтобы составить такую карту, находят разность электронных плотностей молекулы и свободных атомов. В тех местах, где разность положительна, и концентрируется химическая связь.
В-третьих, распределение электронной плотности показывает, к какому из атомов смещены электроны химической связи. Рассмотрим поверхности равной плотности в трёх молекулах, содержащих атомы водорода: LiH, Н2, HF. Поверхности с уровнем 0,002 свидетельствуют о том, что в молекуле LiH электроны смещены к атому водорода, в молекуле Н2 электронная плотность поделена между атомами поровну, а в молекуле HF она смещена к фтору. Если взять больший уровень плотности, например 0,08, то можно видеть, что в молекуле LiH между атомами электронной плотности почти нет, она полностью смещена к атому водорода. Такую связь называют ионной. В молекулах Н2 и HF электронная плотность в основном находится между атомами, что соответствует ковалентной связи, причём в Н2 эта связь симметричная (неполярная), а в HF — несимметричная (полярная).
Наконец, форма уровней электронной плотности даёт представление о геометрии молекул, которое дополняет информацию, полученную из структурных формул.
ИЗ ЧЕГО СОСТОИТ ЭЛЕКТРОННАЯ ПЛОТНОСТЬ? МОЛЕКУЛЯРНЫЕ ОРБИТАЛИ
Электронная плотность создаётся всеми электронами в молекуле. Одни из них при образовании молекулы из атомов остаются практически неизменными, другие меняются очень сильно. Для понимания природы
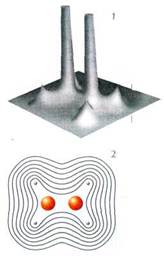
Значения электронной плотности молекулы этилена С2Н4 в плоскости, проходящей через ядра атомов углерода и водорода:
1 — трёхмерное изображение;