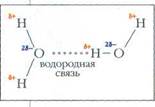
Сеть водородных связей в воле. Красные кружки — атомы кислорода, белые — атомы водорода, синие линии обозначают водородные связи.
единённых связью. Её можно измерить экспериментально. Обычно длина ковалентной связи составляет 0,1—0,2 нм. Самая короткая связь — 0,074136 нм — в молекуле дейтероводорода HD. Длина вандерваальсовой связи может достигать нескольких
ИОННАЯ СВЯЗЬ
Ионная связь возникает при электростатическом притяжении положительно и отрицательно заряженных ионов — катионов и анионов, В отличие от ковалентной, ионная связь не имеет направленности, так как сила притяжения ионов зависит только от расстояния между ними и не зависит от их взаимной ориентации.
Этот тип связи реализуется во многих кристаллических веществах — щелочах (К+ОН-), солях
(Na+Cl-, Ag+NO3-), основных оксидах (Mg2+O2-, Cu2+O2-), карбидах (Ca2+C22-), нитридах (Li+3N3-) и т. д. Наиболее устойчивая кристаллическая структура образуется, когда катион и анион имеют близкие размеры. Число ближайших соседей данного иона называется его координационным числом.
Ионную связь можно рассматривать как предельный случай полярной ковалентной связи, когда электронная пара полностью смещается к одному из атомов. В действительности такого полного смешения никогда не происходит. Например, в кристаллах NaCl реальные заряды на атомах составляют +0,92 и -0,92, а не +1 и -1, как это обычно считается.
МНОГОЦЕНТРОВЫЕ СВЯЗИ
Классические теории трактуют химическую связь как взаимодействие двух атомов. Однако открыто уже довольно много необычных молекул, в которых химическая связь возникает сразу между несколькими атомами. Такие связи называют многоцентровыми.
Простейший пример молекулы с трёхцентровой связью — ион метония СН+5. В нём три из пяти атомов водорода связаны с центральным атомом углерода обычной ковалентной связью. Два других атома водорода удалены от атома углерода на большее расстояние. Трёхцентровую связь между этими атомами осуществляют всего два электрона: один из них предоставлен углеродом, а другой — водородом.
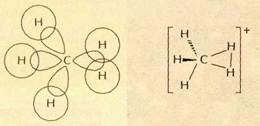
Трёхцентровую связь иногда обозначают треугольником, в вершинах которого находятся связанные атомы.
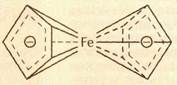
В молекуле ферроцена, или дициклопентадиенилжелеза Fe(C5H5)2, атом Fe, расположенный между двумя циклопентадиенильными кольцами, одновременно связан со всеми десятью атомами углерода обоих колец. Связь между этими 11 атомами осуществляют 12 p-электронов двух ароматических колец.
В металлах электронное облако связывает между собой все атомы — это пример многоцентровой связи.
С открытием многоцентровых связей под химической связью стали понимать коллективное взаимодействие ядер и электронов, описываемое теорией молекулярных орбиталей.