Кристаллическая структура вюрцита ZnS.
между ними лишь в численных значениях параметров решётки.
Известна и другая модификация углерода с гомодесмической структурой — так называемый гексагональный алмаз, или лонсдейлит. Здесь каждый атом углерода тоже находится в тетраэдрическом окружении и имеется пространственный каркас связей С—С, но устроен он иначе, чем в кубическом алмазе. Это пример полиморфизма (от греч. «поли» — «много» и «морфе» — «форма») — существования разных кристаллических форм (полиморфных модификаций) одного и того же вещества, в данном случае простого — углерода.
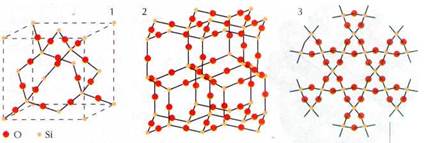
Полиморфизм свойствен и химическим соединениям. Если в структурах алмаза и лонсдейлита половину атомов С заменить атомами Si так, чтобы в ближайшее окружение атомов С входили только атомы Si, а в окружение атомов Si — только атомы С, получатся две модификации карбида кремния SiC. Точно такое же строение имеют две модификации сульфида цинка ZnS — сфалерит и вюрцит.
Если же на серединах отрезков, изображающих ковалентные связи в кристаллах алмаза и лонсдейлита, расположить дополнительные атомы кислорода, а все атомы углерода заменить на кремний, мы получим идеализированные структуры двух модификаций диоксида кремния SiO2 — кристобалита и тридимита, В действительности эти структуры несколько искажены: валентный угол Si—О—Si близок к 145°, что приводит к повышению плотности вещества. Аналогичное строение имеют и кристаллы кварца — наиболее распространённой в природе модификации SiO2. Его отличие — в ином способе сочленения кремнекисло-
ВЫРАСТИМ КРИСТАЛЛ!
Тот, кто побывал в музее минералогии или на выставке минералов, не мог не восхититься изяществом и красотой форм, которые создала «неживая» природа. А кто из нас не любовался снежинками: их разнообразие поистине бесконечно! Ещё в XVII в. знаменитый немецкий астроном Иоганн Кеплер написал трактат «О шестиугольных снежинках», а в XX столетии были изданы альбомы, где представлены тысячи увеличенных фотографий "снежинок, причём ни одна из них не повторяет другую.
Особое место среди кристаллов занимают драгоценные камни, которые с древнейших времён привлекают внимание человека. Невозможно оторвать взгляд от сверкающих всеми цветами радуги алмазов, рубинов, изумрудов, сапфиров, аметистов... Теперь многие драгоценные камни люди научились получать искусственно. Например, подшипники для часов и других точных приборов уже давно делают из искусственных рубинов. А можно создать и такие кристаллы, которых в природе вообще не существует.
Многие видные химики, минералоги и другие учёные начинали свои первые школьные опыты именно с выращивания кристаллов. Опыты эти относительно просты, но их результаты порой могут вызвать удивление и восхищение.
Чтобы вырастить кристалл, полезно знать, какие процессы управляют его ростом; почему разные вещества дают кристаллы различной формы, а некоторые вовсе не образуют кристаллов; что надо сделать, чтобы кристаллы получились большими и красивыми.
Форма кристалла зависит от формы и размера частиц данного вещества (атомов, ионов или молекул), а также от того, как они друг с другом взаимодействуют. Представьте себе, что вы укладываете паркет, а товарищ подаёт вам плитки. Легче всего работать с плитками квадратной формы — такую как ни поверни, она всё равно подойдёт к своему месту. Труднее выложить паркет из прямоугольных дощечек и особенно сложно, если у них имеются пазы и выступы, — тогда каждую можно уложить на место лишь единственным способом. А теперь вообразите, что ваш помощник очень торопится и подаёт
плитки быстрее, чем вы успеваете укладывать. Тут уж правильного узора не получится: где-то плитку перекосит, и дальше всё пойдёт криво, где-то появятся пустоты (как в известной компьютерной игре «Тетрис», когда «стакан» заполняется деталями слишком быстро, и вы не успеваете уложить их без пропусков). Ничего хорошего не выйдет и в том случае, когда паркет начнут укладывать сразу десяток мастеров, каждый со своего места. Даже если они будут работать не спеша, крайне сомнительно, что соседние участки окажутся хорошо состыкованными. Скорее всего в разных местах плитки расположатся в разном направлении, а между отдельными участками ровного паркета будут зиять дыры.
Примерно то же происходит и при росте кристаллов, только здесь всё ещё сложнее: частицы должны выстраиваться не в плоскости, а в объёме. Но ведь никакого «паркетчика» тут нет — кто же укладывает частицы вещества на свои места? Оказывается, они делают это сами, непрерывно двигаясь и выбирая место, где им будет наиболее удобно. Если кристаллизация идёт очень медленно, получается один большой
родных тетраэдров, обеспечивающем ещё более высокую плотность. Однако усложнение структуры не приводит к изменению её характера: структура остаётся гомодесмической, сцепление атомов осуществляется ковалентными связями.
Поскольку металлические и ионные связи характеризуются отсутствием направленности, образованные такими связями кристаллические структуры часто можно изобразить в виде плотных шаровых упаковок. Три варианта подобных упаковок реализуются в металлах — это структуры меди, магния и железа. В первых двух координационное число равно 12, в третьей — 8. Так же построены и другие металлы: алюминий, платина, золото — по типу меди; бериллий, кобальт, рутений — по типу магния; калий, барий, ванадий — по типу железа.