Всем, кто пьёт сладкий чай, известно, какой замечательной растворимостью в горячей воде обладает сахар.
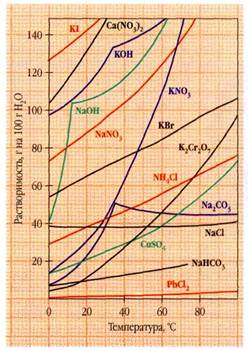
растворялось бы любое вещество. Поиски алкагеста прекратились, когда люди наконец догадались, что такое вещество просто не в чем будет держать: ведь по определению оно должно растворять любую посуду. Правда, есть одно довольно распространённое вещество, которое могло бы, по крайней мере отчасти, претендовать на роль универсального растворителя. Это — обыкновенная вода. Растворимость некоторых веществ в воде удивительна. Общеизвестна прекрасная растворимость в ней сахара — почти полкило на 100 г кипятка. А рекорд принадлежит, вероятно, трихлориду сурьмы SbCl3: в 100 г даже ледяной воды можно растворить 602 г твёрдого трихлорида, а при температуре 40 °С — 1368 г!
Химикам-аналитикам хорошо известно, что вода немного растворяет даже стекло. Если растирать в ступке порошок стекла с водой, то в присутствии индикатора — фенолфталеина — появится розовая окраска, а это признак щелочной среды. Следовательно, вода частично растворила стекло, и щёлочь попала в раствор (недаром химики называют этот процесс выщелачиванием стекла).
Вот почему так трудно получить абсолютно чистую воду, которая необходима для точного определения физических свойств этого вещества.
НАБЛЮДАЮ ХОЛОД И КИПЕНИЕ
Одно из самых удивительных свойств растворов можно наблюдать зимой на улице: когда слежавшийся снег и лёд посыпают солью, они начинают таять даже в сильный мороз! Происходит это потому, что раствор соли в воде замерзает при более низкой температуре, чем чистая вода. Обычная поваренная соль способна «растопить» лёд при температуре -21,2 °С, а хлорид кальция — при -55 °С
В 1788 г. английский физикохимик и военный врач Чарлз Благден (1748—1820) опубликовал «Опыты над способностью некоторых веществ понижать температуру замерзания воды». Учёный установил, что