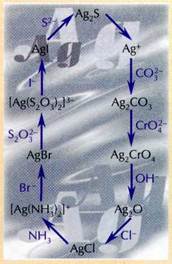
Осадки хлорида, бромида и иодида серебра.
только найти вещество, которое снизит концентрацию в растворе хотя бы одного из её ионов.
Эти рассуждения можно проиллюстрировать эффектной цепочкой превращений, в которых участвуют ионы серебра. Выпишем значения ПР типичных нерастворимых соединений серебра и рассчитаем по ним концентрации ионов серебра в водном растворе над осадком:
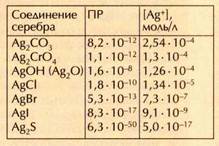
Уже первое вещество — Ag2CO3 в воде практически не растворяется. Но если добавить к бесцветному раствору над желтоватым осадком Ag2CO3 несколько капель раствора хромата калия К2СrО4 и перемешать смесь, осадок Ag2CO3 немедленно исчезнет и появится тёмно-красный осадок Ag2CrO4. Произошло это потому, что ионы Ag+, находящиеся над осадком Ag2CO3, начали быстро связываться хромат-ионами в менее растворимое соединение. На смену им из осадка стали поступать новые ионы серебра, которые тут же «перехватывались» хромат-ионами. В конце концов все ионы серебра, входившие в состав карбоната, вошли в состав нового осадка — хромата серебра.
Аналогично хромат серебра легко превратить в менее растворимый тёмно-коричневый оксид серебра Ag2O, затем — в ещё менее растворимый белый осадок AgCl. Если теперь к AgCl добавить немного раствора аммиака, осадок моментально растворится: ионы Ag+ свяжутся с молекулами аммиака в прочный комплекс состава [Ag(NH3)2]+.
Однако в растворе ещё остаётся небольшое количество свободных ионов серебра, поэтому при добавлении бромида калия аммиачный комплекс начинает распадаться, выделяя новые
и новые порции ионов Ag+, которые немедленно переходят в осадок AgBr. Чтобы он растворился, выбирают комплексообразователь посильнее. Им служит, например, тиосульфат натрия Na2S2O3, анионы которого в растворе образуют более прочный, чем аммиак, комплекс состава [Ag(S2O3)2]3-. Именно поэтому тиосульфат натрия используют в фотографии для растворения бромида серебра.
В присутствии тиосульфата в растворе осталось ещё меньше свободных ионов серебра, но их концентрация достаточна, чтобы при добавлении иодида калия достичь величины ПР для AgI; эта соль и выпадет в осадок жёлтого цвета. Настала очередь иодида. Растворить его ещё труднее, чем бромид, — уж очень мала концентрация Ag+ в растворе над осадком. Но если к осадку добавить раствор сульфида натрия, он сразу почернеет: это образовался Ag2S — наименее растворимая соль серебра.
Серебро из сульфида можно перевести в раствор с помощью азотной кислоты: 3Ag2S + 8HNO3=6AgNO3+2NO+3S+4Н2О. Круг замкнулся: серебро снова находится в виде хорошо растворимой соли — нитрата. Итак, путешествие ионов серебра из осадка в раствор и обратно закончилось. Вот карта его маршрута:
KNO3, NH4NO3 и некоторых других — охлаждается. Охлаждение может быть таким сильным, что стакан, в котором готовят раствор, покрывается снаружи росой или даже примерзает к мокрой подставке.
НЕ ТОЛЬКО В ВОДЕ
Растворы могут быть не только водными. Удивительными свойствами обладают, например, растворы различных веществ в жидком аммиаке. Так, химические реакции с участием солей в жидком аммиаке часто протекают совсем иначе, нежели в воде, прежде всего потому, что растворимость одних и тех же веществ в воде и в жидком аммиаке может очень сильно различаться. Существенно меняются в жидком аммиаке и кислотно-основные свойства веществ. В результате в этом растворителе легко протекают такие реакции, которые немыслимы для водных растворов, например: Ba(NO3)2+2AgCl=BaCl2+2AgNO3;
2NH3+6K+6KNO3=6KOH¯+N2+6KNO2+3H2; 2K+2CO=K2C2O2.
Последнее соединение содержит тройную ацетиленовую связь и имеет строение
K+O-—CºC—O-K+.
Очень необычны растворы щелочных металлов в жидком аммиаке. Они имеют красивый синий цвет и хорошо проводят ток. Растворы с концентрацией более 3 моль/л иногда называют жидкими металлами: они обладают отчётливым металлическим блеском с золотисто-бронзовым отливом. Концентрированный раствор лития в жидком аммиаке — самая лёгкая при обычных условиях жидкость, её плотность при 20 °С равна всего 0,48 г/см3.
Если смешать два расплавленных металла, то получившуюся жидкость тоже следует считать раствором. Как и для водных растворов, введение второго компонента понижает температуру плавления «растворителя». Это явление применяется в производстве легкоплавких припоев (материалов, нужных для паяния). Самый известный из них — сплав третник, содержащий 2/3 олова и 1/3 свинца.
«ШУБА» ДЛЯ ИОНОВ
Исследование тепловых эффектов при разбавлении серной кислоты дало поразительные результаты. Оказалось, чем сильнее разбавляется серная кислота, тем больше теплоты выделяется. Даже когда на 1 моль H2SO4 приходится 500 тыс. молей воды, гидратация ионов Н+ и SO2-4 ещё не заканчивается полностью. Дело в том, что вокруг каждого иона образуется многослойная сфера из огромного числа молекул воды — химики образно называют такой слой «гидратной шубой» иона. Молекулы первого слоя сильно притягиваются к центральному иону, молекулы второго слоя притягиваются к молекулам первого слоя, но уже слабее, и т. д. Эта «шуба», которую ионы постоянно «таскают за собой» по раствору, не позволяет им перемещаться так же свободно, как молекулам газа. Именно наличием «шубы», а ещё сильным взаимным притяжением катионов и анионов в концентрированных растворах объясняются трудности при количественном описании электропроводности, степени диссоциации и других свойств растворов.
Чистое олово плавится при 232 °С, свинец — при 327 °С, а третник — при 177 °С. Сплав 80 % калия и 20% натрия плавится при 10 °С и применяется в качестве теплоносителя в атомных реакторах. Сплав ртути с таллием (8,5% Т1), замерзающий при температуре ниже -60 °С, прекрасно подходит для низкотемпературных термометров.
Однако так бывает далеко не всегда. Если разница атомных радиусов двух металлов невелика (меньше 15 %), а температуры плавления этих металлов различаются не более чем на 27 %, то при затвердевании жидкого сплава образуется так называемый твёрдый раствор, в котором атомы двух металлов, как и в жидкости, равномерно «перемешаны». Температура плавления твёрдого раствора — промежуточная между двумя металлами и зависит от их соотношения. Электропроводность твёрдого раствора двух металлов обычно бывает меньше, а твёрдость — больше, чем у каждого из компонентов в отдельности. Это используется, например, при изготовлении монет (твёрдые растворы меди с никелем и цинком), ювелирных изделий (твёрдые растворы золота с серебром, медью, палладием, платиной).
