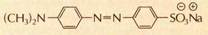При переходе от кислой среды к щелочной окраска лакмуса меняется с красной на синюю.
начале XIV в. во Флоренции вновь была открыта фиолетовая краска орсейль, тождественная лакмусу, причём способ её приготовления в течение многих лет держали в секрете.
Готовили лакмус из специальных видов лишайников. Измельчённые лишайники увлажняли, а затем добавляли в эту смесь золу и соду. Приготовленную таким образом густую массу помешали в деревянные бочки, добавляли мочу и выдерживали длительное время. Постепенно раствор приобретал тёмно-синий цвет. Его упаривали и в таком виде применяли для окрашивания тканей. В XVII столетии производство орсейли было налажено во Фландрии и Голландии, а в качестве сырья использовали лишайники, которые привозили с Канарских островов.
Похожее на орсейль красящее вещество было выделено в XVII в. из гелиотропа — душистого садового растения с тёмно-лиловыми цветками.
Знаменитый физик и химик XVII в. Роберт Бойль писал о гелиотропе: «Плоды этого растения дают сок, который при нанесении на бумагу или материю имеет сначала свежий ярко-зелёный цвет, но неожиданно изменяет его на пурпурный. Если материал замочить в воде и отжать, вода окрашивается в винный цвет; такие виды красителя (их обычно называют «турнесоль») есть у аптекарей, в бакалейных лавках и в других местах, которые служат для окраски желе, или других веществ, кто как хочет». С того времени орсейль и гелиотроп стали использовать в химических лабораториях. И лишь в 1 704 г. немецкий учёный М. Валентин назвал эту краску лакмусом.
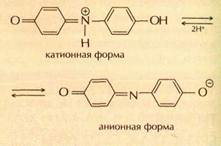
Сегодня для производства лакмуса измельчённые лишайники сбраживают в растворах поташа (карбоната калия) и аммиака, затем в полученную смесь добавляют мел или гипс. Считается, что красящими веществами лакмуса являются индофенолы, которые в кислой среде существуют в катионной форме, а в щелочной — в анионной, например:
В некоторых странах краску, сходную с лакмусом, добывали и из других растений. Простейшим примером слу-

В сильнокислой среде индикатор метиловый оранжевый имеет красную окраску, в слабокислой и нейтральной — оранжевую, а в щелочной — жёлтую.
донором электронной пары. Так, в реакции образования иона аммония молекула аммиака служит основанием, а ион водорода — кислотой:
N••H3+Н+®NH+4
Теория Льюиса позволяет включить в число кислот и оснований вещества, не содержащие водорода. Например, бромид железа(Ш) является кислотой Льюиса, поскольку атом железа выступает акцептором (у него есть вакантные орбитали), а бромид-ион — основанием Льюиса (у него имеются электронные пары). Кислота и основание Льюиса реагируют друг с другом:
FeBr3+Br-= FeBr4-.
Cuльную кислоту Льюиса представляет собой фторид сурьмы (V) SbF5 — бесцветная вязкая жидкость, разлагающаяся водой. При растворении её в безводной фторсульфоновой кислоте HSO3F льюисова кислотность раствора повышается настолько, что