рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Основы Химии
Реферат Курсовая Конспект
Основы Химии
Основы Химии - раздел Химия, Сумасшедшие Реакции ...
СУМАСШЕДШИЕ РЕАКЦИИ
НЕРНСТА: «ЭФФЕКТ ДОМИНО» К концу XIX в. дружными усилиями физиков и химиков была разработана важнейшая глава физической химии — учение о…Механизм цепного процесса подобен эффекту домино. Зарождение, рост и обрыв цепи.
Цепной механизм реакции получил блестящее экспериментальное подтверждение. Известно, что если газ нагревать неравномерно, в нём образуются горячие… Если смесь нагрета несильно или интенсивность света невелика, реакция идёт… Теория цепей хорошо объясняла особенности протекания реакции водорода с хлором (и некоторых других сходных реакций).…Горение водорода в хлоре.

Вальтер Нернст.
В 1918 г. немецкий физикохимик, лауреат Нобелевской премии Вальтер Нернст предложил свой механизм этой реакции. Он предположил, что активными… (Неспаренный электрон часто обозначают точкой.) Обрыв цепей происходит, когда активные атомы Н или С1 реагируют с…Схема установки Ф. А. Панета.
СВОБОДНЫЕ РАДИКАЛЫ МОГУТ БЫТЬ СВОБОДНЫМИ!
Много лет химики под понятием «радикалы» подразумевали части целой молекулы или некоторые гипотетические промежуточные частицы. Любые попытки получить радикалы в свободном состоянии терпели неудачи. Поэтому мало кто верил, что они действительно могут быть «свободными». Традицию нарушил молодой американский учёный Мозес Гомберг — основатель химии свободных радикалов. В 1900 г. он опубликовал статью с необычным для того времени названием «Трифенилметил, случай трёхвалентного углерода».
Пытаясь синтезировать гексафенилэтан (С6Н5)3С—С(С6Н5)3 Гомберг воздействовал на трифенилхлорметан C(C6H5)3Cl порошком серебра. Он хорошо знал, что в подобных реакциях атомы серебра отрывают атомы хлора от молекул хлорированных углеводородов, а оставшиеся «осколки» (радикалы) тут же рекомбинируют — соединяются между собой. Например, в случае хлорбутана получался октан: 2C4H9Cl+2Ag® С8Н18+2AgCl. Логично было предположить, что из трифенилхлорметана получится гексафенилэтан.
Гомберг провёл реакцию и выделил продукт, при анализе которого с удивлением обнаружил кроме углерода и водорода также кислород. Очевидно, что источником его служил воздух, однако было неясно, как кислород оказался участником реакции. Учёный повторил опыт, тщательно оберегая реакционную смесь от воздуха. Результат получился не менее поразительный. Во-первых, раствор оказался не бесцветным, а жёлтым; появление окраски свидетельствовало об образовании другого вещества. Во-вторых, выделенный в инертной атмосфере продукт по составу был таким же, как гексафенилэтан, а по свойствам разительно отличался от него: даже при низкой температуре быстро реагировал с кислородом, бромом и иодом. Гексафенилэтан в такие реакции вступать никак не мог.
Гомберг выдвинул смелую гипотезу: в реакции образуется свободный радикал — трифенилметил (С6Н5)3С. Неспаренный электрон делает его весьма активным по отношению к галогенам и к кислороду. Поэтому на воздухе к радикалу присоединяется кислород.
Химик предположил также, что в инертной атмосфере реакция идёт не до конца и существует равновесие между радикалами и продуктом их сдваивания. На это указывало и измерение молекулярной массы продукта, которая оказалась больше, чем у трифенилметана, но меньше, чем у его димера — гексафенилэтана. Доводы учёного были признаны убедительными, и радикал трифенилметил получил название радикала Гомберга.
Кстати, необычным оказалось и окончание статьи Гомберга: «Работа будет продолжена, и я хотел бы зарезервировать данную тему за собой». В изданной в 1999 г. «Книге рекордов в химии» такое заявление было названо «самой замечательной концовкой статьи по химии».

стекла образовался блестящий слой металла — свинцовое зеркало. После этого горелку передвинули в точку 2, продолжая слегка подогревать зеркало и в точке 1. Вскоре в точке 2 образовалось новое свинцовое зеркало, но одновременно прежнее, в точке 1, исчезло. При этом в ловушке появился тетраметилсвинец. Время исчезновения зеркала было прямо пропорционально количеству содержащегося в нём свинца и обратно пропорционально скорости исчезновения зеркала в точке 1. Аналогичные результаты были получены с зеркалами из висмута, цинка и сурьмы при использовании соответственно триметилвисмута (CH3)3Bi, диметилцинка (CH3)2Zn или триметилсурьмы (CH3)3Sb. Висмутовое зеркало в точке 1 исчезало и в
том случае, когда в точке 2 получали свинцовое зеркало, и наоборот. Если точка 2 оказывалась слишком далеко от точки 1, то металлическое зеркало там оставалось нетронутым; однако можно было добиться его исчезновения, увеличив скорость потока газа через трубку.
Этот замечательный опыт наглядно показал, что при распаде тетраметилсвинца действительно образуются свободные метильные радикалы: (СН3)4Рb ® 4С•Н3+Рb. В токе инертного азота они могут «жить» некоторое время, а исчезают либо за счёт рекомбинации, превращаясь в этан: 2С•Н3®С2Нб, либо реагируя с металлическим зеркалом: 4С•Н3+Рb®(CH3)4Pb; 2C•H3+Zn ®(CH3)2Zn и т. д. Зная скорость газового потока
«КАПРИЗЫ» ХИМИЧЕСКИХ РЕАКЦИИ
В один из дней 1967 г. в Большой химической аудитории химического факультета МГУ имени Ломоносова яблоку негде было упасть. Ещё бы: выступал знаменитый академик, единственный отечественный лауреат Нобелевской премии по химии Николай Николаевич Семёнов. Он много рассказывал о цепных реакциях, изучению которых посвятил лучшие годы жизни. Вспоминая пионеров химической кинетики, в частности своего заочного учителя — нидерландского химика Якоба Вант-Гоффа (ему Семёнов посвятил в 1934 г. книгу Цепные реакции»), Николай Николаевич сказал:
«Вант-Гофф сетовал на „возмущающие" действия, или „капризы", химических превращений, мешавшие ему извлечь простые законы кинетики из хода большого числа реакций, часто даже невоспроизводимых. В физике, как известно, „капризов" практически нет, в то время как биология полна ими. Химия занимает промежуточное положение: иногда реакция течёт нормально, а иногда — сплошные „капризы". Такое положение, пожалуй, хуже всего для учёного. Мы думаем, что цепная теория — это теория „капризов" химического превращения. Она раскрывает причины появления и устанавливает закономерности, управляющие этими „возмущающими" действиями. Цепная теория пока, к сожалению, лишь отчасти избавляет учёных от тяжёлых переживаний, вызываемых внезапными, казалось бы, бессмысленными нарушениями нормального хода реакции. Вскрытие причин таких „капризов" даёт мощное средство управления ходом и направлением химических процессов...».

Николай Николаевич Семёнов.
и время исчезновения зеркала при разных расстояниях между точками 1 и 2, можно оценить время жизни метильныхрадикалов в свободном состоянии. По данным экспериментаторов, концентрация метильных радикалов в токе инертного газа при давлении 3•10-3 атм (300 Па) снижалась в два раза примерно за 0,006 с. После доказательства существования свободных радикалов были изучены разнообразные реакции с их участием. Многие радикальные реакции оказались цепными, их механизм в общих чертах был сходен с наблюдаемым у реакции водорода с хлором. По цепному механизму протекают реакции расщепления при высоких температурах (пиролиз) углеводородов, например этана: С2Н6®С2Н4+Н2. Подобные процессы имеют большое значение при промышленной переработке утлеводородов нефти. Цепными оказались реакции окисления органических веществ кислородом, реакции присоединения к непредельным углеводородам галогенов (хлора и брома), бромоводорода и других соединений, реакции полимеризации, ряд других процессов.
ЦЕПИ СЕМЁНОВА — ХИНШЕЛВУДА: «ЭФФЕКТ СПЛЕТЕН»
В конце 1924 г. заведующий лабораторией электронной химии Ленинградского физико-технического института Николай Николаевич Семёнов (1896—1986) поручил недавней выпускнице университета Зинаиде Вальта исследовать, как зависит от условий проведения реакции интенсивность свечения при окислении белого фосфора. Как вспоминал Семёнов, тема эта была далека от его научных интересов. Знал бы молодой физик, чем обернётся его тогдашнее распоряжение!
В первых же опытах 3. Вальта и её непосредственный руководитель, впоследствии академик, Юлий Борисович Харитон (1904—1996) столкнулись с неожиданным явлением. Оказалось, что, когда кислорода мало, реакция окисления 4Р+5О2=2Р2О5 вообще не идёт. Но стоило давлению кислорода превысить некоторое критическое значение, как начиналось интенсивное окисление фосфора с испусканием света. Как раньше считалось, скорость реакции должна плавно возрастать с увеличением концентрации реагентов. Здесь же — резкий переход от полного отсутствия реакции к очень быстрому процессу при ничтожном изменении давления кислорода. Обнаружился и ещё один, совсем уж странный факт: при давлении ниже критического, т. е. в отсутствие реакции, достаточно было ввести в сосуд аргон, чтобы произошла яркая вспышка. Получалось, что инертный газ, не способный ни к каким химическим реакциям, делал кислород реакционноспособным! Тогда это казалось настоящим чудом...
Позже выяснилось, что кислород может полностью терять свою активность не только при снижении, но и при повышении давления выше некоторого критического значения. Этот второй (верхний) предел давления кислорода необычайно сильно зависел от примесей различных веществ. Некоторые из таких примесей делали «пассивный» кислород весьма активным, вызывающим горение фосфора. Такое поведение противоречило всем существовавшим тогда представлениям о механизмах и скоростях химических реакций.
Результаты этих «странных» экспериментов были опубликованы в немецком «Физическом журнале». Последствия оказались весьма неутешительны: работа подверглась острой критике со стороны знаменитого Боденштейна, который к тому времени считался главой мировой химической кинетики. В том же журнале он написал, что все результаты по окислению фосфора являются не открытием, а иллюзией и указал даже на её причину — неправильную конструкцию установки, в которой проводились опыты.
Возражения были серьёзные. Ленинградским исследователям пришлось переделывать установку. Однако в итоге их ждал полный успех! Удалось не только воспроизвести прежние результаты, но и получить новые, не менее «еретические». Например, такой: критическое давление кислорода сильно зависит от размеров реакционного сосуда.
Семёнов почувствовал, что стоит на пороге открытия. Реакция явно была цепной, наподобие реакции водорода с хлором. Однако механизм цепной реакции Боденштейна — Нернста, основанный на «принципе домино», никогда не приводил (и не мог приводить) к критическим явлениям. Здесь было что-то иное. Поставили новые эксперименты с другими реакциями. Одновременно в этом направлении начал работать в Оксфорде Сирил Хиншелвуд.
В обеих лабораториях критические явления удалось обнаружить в реакциях горения водорода и ряда
других веществ. Как оказалось, в стеклянных термостойких сосудах при температурах 500—600 °С реакция водорода с кислородом не идёт вовсе, пока давление не достигнет 400— 520 Па (3~4 мм рт. ст.). Когда оно превышает этот нижний предел, внезапно начинается быстрая реакция, сопровождающаяся свечением. При температурах ниже 400 °С воспламенение смеси не наблюдается ни при каких давлениях. Однако достаточно добавить к ней инертный газ, и происходит вспышка!
Все эти новые явления Семёнов и Хиншелвуд объяснили одинаково — предположением о разветвляющихся цепях. Если в реакции водорода с хлором на каждой стадии продолжения цепи одна активная частица расходуется и одна — появляется (неразветвлённая цепь), то при взаимодействии водорода с кислородом в результате трёх последовательных реакций продолжения цепи:
H+O2®OH+O O+H2®OH+H
OH+H2 ®H2O+H
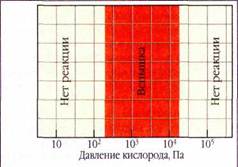
Нижний и верхний пределы по давлению кислорода для реакции воспламенения фосфора.
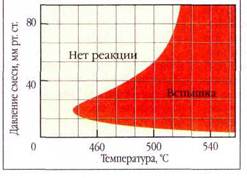
Полуостров воспламенения для смеси водорода и кислорода.
Два типа лавин по Семёнову. вместо одного атома водорода возникают три свободных радикала (два атома… Оба учёных дали объяснение и необычным характеристикам разветвлённо-цепных реакций. При низких давлениях большинство…ПРЕВРАЩЕНИЯ АТОМНЫХ ЯДЕР

Вильгельм Конрад Рентген.
В конце XIX столетия учёные находились под впечатлением обнаруженных в 1895 г. немецким физиком Вильгельмом Конрадом Рентгеном невидимых лучей,… Французский физик Антуан Анри Беккерель (1852—1908) решил выяснить, не могут… Однажды учёный, как обычно, приготовил образцы, однако деньДоказательство открытия радиоактивности. Клише с автографом А. А. Беккереля. 1896 г.
«Луч» по-латыни — radius, и потому самопроизвольное испускание атомами излучения получило название радиоактивности. Новым явлением заинтересовались многие учёные. Среди них были работавшие во… 1934), которая, кстати, и ввела термин «радиоактивность». Они решили выделить источник излучения из урановой руды.…Пьер и Мария Кюри в лаборатории. 1896 г.
*Радионуклид — нуклид, ядра которого радиоактивны.
**Радиоактивный элемент — химический элемент, все нуклиды которого радиоактивны.
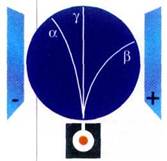
Источник излучения
Компоненты радиоактивного
Излучения.
ВИДЫ РАДИОАКТИВНЫХ ПРЕВРАЩЕНИЙ Было установлено, что a-лучи представляют собой ядра гелия 42Не. В результате… Изучение b-лучей показало, что это поток электронов. В ядрах некоторых нуклидов нейтрон способен превращаться в…Схема деления ядра.
Скорость радиоактивного распада обычно характеризуют периодом полураспада Т1/2. За это время число ядер уменьшается в два раза. Зная период полураспада, можно рассчитать, сколько радионуклида останется через определённое время. Если радиоактивных атомов мало, подобные расчёты неосуществимы — можно говорить только о вероятности их распада за определённое время. Для каждого радионуклида значение Т1/2 постоянно.
Если радионуклид распадается быстро, то он называется короткоживущим. Значения Т1/2 для таких радионуклидов могут составлять 10-10— 10-12 с и меньше. Например, для сверхлёгкого изотопа кислорода 12О Т1/2 = 10-21 с. Для долгоживущих, медленно распадающихся ядер значения Т1/2 иногда достигают многих миллиардов лет. Для природных радионуклидов 238U,40К и 232Th Т1/2 равны соответственно 4,47•109, 1,28•109 и 1,405•1010 лет. В этом случае можно полностью пренебречь убылью атомов и за 100, и за 1000 лет. Рекордно длительным периодом полураспада обладает радионуклид 113Сd — 9•1015лет!
Сравнительно короткоживущие радионуклиды франция, радия, актиния, протактиния и других элементов образуются с постоянной скоростью при радиоактивном распаде долгоживущих природных изотопов: урана-238, урана-235 и тория-232.
Зная значение T1/2 радионуклида, можно найти его активность а — число ядер, распадающихся за 1 с в образце, который содержит N атомов радионуклида: а = (0,693/T1/2)•N. Единицей активности в СИ служит беккерель (Бк), соответствующий одному распаду в секунду. Активность, равная 1 Бк, очень маленькая. Достаточно сказать, что активность тела человека составляет примерно 100 Бк. Поэтому часто используют производные единицы: килобеккерель (1кБк=1000 Бк); мегабеккерель (1МБк=1000000 Бк) и др.
Активность нашего тела связана в основном с наличием калия (природный калий включает 0,012% радио-
нуклида 40К). Кроме того, в живых организмах содержатся микроколичества урана, радия, углерода 14С (его иногда называют радиоуглеродом), трития 3Н, некоторых других радиоактивных элементов, постоянно присутствующих в окружающей среде.
КАК ПОЛУЧАЮТ
ИСКУССТВЕННЫЕ
РАДИОНУКЛИДЫ
Для получения радионуклидов используют ядерные реакции. От химической ядерная реакция отличается тем, что в ходе её изменяются ядра, и, следовательно, одни атомы превращаются в другие. В таких реакциях участвуют ядра-мишени атомов различных элементов, а снарядами (бомбардирующими частицами) чаще всего служат нейтроны, протоны, дейтроны (ядра атомов тяжёлого водорода — дейтерия 21H), a-частицы, а иногда также g-кванты с большой энергией или ядра других атомов (более лёгких, чем ядра атомов-мишеней).
Первую ядерную реакцию осуществил в 1919 г. Эрнест Резерфорд. Он облучал a-частицами атомы азота.

Эрнест Резерфорд.
ИСТОЧНИКИ НЕЙТРОНОВ В реакциях ядерного синтеза источником нейтронов может служить небольшая… Наиболее мощный источник нейтронов — ядерный реактор. Поток нейтронов в каналах ядерного реактора достигает 1013—1014…Схема устройства циклотрона.
Ускоряемая электрическим
И магнитным полем частица движется
Позднее было доказано, что в этом опыте образовались две новые частицы — ядро кислорода-17 и протон: 147N+42Не ®178О+11Н. Энергия, связанная с ядерными реакциями, неизмеримо больше, чем энергия любой химической реакции. При протекании ядерной реакции суммарные значения заряда и массовых чисел…Шаровые модели молекул.
По определению, простое вещество — это форма существования химического элемента в свободном состоянии. Но это определение нередко вызывает споры… каждый из них содержит атомы только одного элемента — водорода. Множество форм существования и у кислорода: две разновидности газообразного (они различаются электронным строением…Символы элементов и химических соединений, предложенные Дж. Дальтоном.
Водород,
Азот,
Углерод,
Кислород,
Фосфор,
Сера,
Магнезия,
Известь,
Натр,
Кали,
Стронциан,
Барит,
Железо,
Цинк,
Медь,
Свинец,
Серебро,
Платина,
Золото,
Ртуть,
Вода,
Аммиак,
Селитряный газ,
Маслородный газ,
Оксид углерода,
Оксид азота,
Селитряная кислота,
Угольная кислота,
Метан,
Надселитряная кислота,
Серная кислота,
Сернистый водород,
Спирт,
Селитроватая кислота,
Уксусная кислота,
Нитрат аммония,
Сахар.
Некоторые вещества, которые учёный относил к числу простых (например, магнезия, известь), на самом деле образованы атомами нескольких элементов. В то время считали, что вода состоит из одного атома водорода и одного атома кислорода, а аммиак —
Из одного атома водорода и одного атома азота.
ществлённой в 1858—1860 гг. итальянским химиком Станислао Канниццаро. Он впервые чётко разграничил понятия «атом» и «молекула», определил и… АТОМНЫЕ МАССЫ: ГИПОТЕЗА ПРАУТА В 1815 г. английский химик и врач Уильям Праут (1785—1850) опубликовал статью «О связи между удельным весом тел в…Одной из первых была предложена водородная шкала атомных масс. Атомные массы всех элементов рассчитывались по отношению к атомной массе водорода.
Это была очень интересная и прогрессивная идея. Из неё следовало, как писал Праут, что водород — это та самая «первоматерия» древнегреческих… Однако после первого восхищения смелой гипотезой энтузиазм большинства…Многие выдающиеся ученые XIX в. не верили в существование атомов. Даже такие светила химии, как Бертло, Оствальд, Девилль, отрицали идею атомарного строения вещества.
отношения масс атомов Н и О повлияло бы только на атомную массу водорода. В результате была принята так называемая кислородная шкала:

ТАК РАБОТАЛ СТАС
Пользуясь новой шкалой атомных масс, Стас провёл ряд очень точных определений. Сливая растворы тщательно очищенных AgNO3 и NaCl, он отделял и взвешивал осадок AgCl. Проведя десять опытов, учёный установил, что ровно 100 г серебра реагируют с 54,2078 г NaCl. Далее из хлора и серебра он синтезировал AgCl. По данным семи независимых опытов, из 100 г серебра получается 132,8445 г AgCl. Отсюда легко рассчитать, что 32,8445 г хлора соединяется со 100 г серебра и с 21,3633 г натрия. Затем Стас показал, что из 100 г хлората серебра в результате его разложения (2AgClO3=2AgCl+3О2) получается 74,9205 г AgCl, и, следовательно, 25,0795 г кислорода. Принимая массу атома кислорода равной 16,000, он нашёл относительные атомные массы серебра (107,94), хлора (35,45) и натрия (23,05), очень близкие к современным значениям. Эта работа Стаса позволила Менделееву говорить о том, что гипотеза Праута не выдерживает экспериментальной проверки.
масса атома кислорода считалась равной 16,0000 (точно), а единицей измерения стала 1/16 этой массы. Относительные атомные массы всех элементов увеличились примерно на 0,8 %. С конца XIX в. кислородной единицей пользовались уже все химики. А точность определения атомных масс продолжала повышаться, так что в таблицу элементов всё время приходилось вносить поправки. В установлении атомных масс многих химических элементов велика заслуга американского химика Теодора Уильяма Ричардса (1868—1928). С помощью приборов собственной конструкции он определил массы 25 химических элементов и исправил ошибки, допущенные ранее другими химиками. В 1914 г. Ричардс измерил атомную массу свинца, выделенного из разных минералов, содержащих уран и торий. Оказалось, что их значения несколько отличаются. Так было доказано существование разновидностей (изотопов) свинца; в природе они являются конечными продуктами радиоактивного распада урана, тория и актиния. В том же году Ричардс, первым из американских химиков, получил Нобелевскую премию «за точные определения атомных весов ряда химических элементов».
ОТ КИСЛОРОДНОЙ ЕДИНИЦЫ К УГЛЕРОДНОЙ
Казалось, химикам и впредь оставалось лишь уточнять значения атомных масс по кислородной шкале. Однако с открытием изотопов — сначала для радиоактивных элементов, а затем и для стабильных, гипотеза Праута получила новую жизнь. Действительно, отсутствие «простых кратных отношений», на которые указывал Менделеев, легко можно было объяснить тем, что элементы состоят из нескольких изотопов, т. е. сортов атомов с одинаковым зарядом ядра Z, но с разным числом нейтронов. Атомные же массы отдельных изотопов в самом деле очень близки к целым числам. Близки, но всё же не целые.
Чтобы говорить о состоятельности гипотезы Праута после открытия изотопов, необходимо было иметь как можно более точные значения атомных масс. И тут-то выяснилось — столь удобная кислородная шкала далека от совершенства. Ведь химики, измеряя, подобно Стасу, соотношения между массами вступающих в реакцию элементов, всегда имели дело с природной смесью изотопов. Не составлял исключения и кислород: в природе он представлен смесью трёх нуклидов: 16О, 17О и 18О. Первый нуклид преобладает — его 99,759%, второго — всего 0,037%, третьего — 0,204%. Для использования кислородной единицы это было бы не страшно, будь соотношение изотопов в природном кислороде строго постоянным. Но оно, хотя и в слабой степени, колеблется, так что кислородная единица «плавала»; её значение относительно массы атома 16О могло меняться в 1,000268—1,000279 раза. Для практических расчётов, например при химическом анализе, такие ничтожные колебания не имели значения. Однако многих учёных не удовлетворяла сама постановка вопроса: как можно точно измерять относительные атомные массы, если единица измерения не вполне постоянна? Поэтому наряду с «химиче-

Теодор Уильямс Ричардс.
Если сравнить относительные атомные массы элементов Аr в таблице Менделеева, можно обнаружить некоторые, на первый взгляд, «странности». Одна из… Оказывается, точность, с которой определяется относительная атомная масса… Вторая «странность» заключается вот в чём. Относительные атомные массы, рассчитанные по «физической кислородной шкале»…При диссоциации кислот происходит разрыв связи О—Н, а при диссоциации оснований — отделение ОН-группы.
Н3РО4) и бескислородные (соляная кислота НСl, сероводородная кислота H2S). Основания, или гидроксиды (старые русские их названия — гидроокиси, гидраты… Гидроксиды щелочных и щёлочноземельных металлов, хорошо растворимые в воде, называются щелочами. Щёлочи — твёрдые…Соединения
С амфотерными
Свойствами обладают
Своеобразной
Химической
ГИДРОЛИЗ СОЛЕЙ Гилролизом соли называется реакция её взаимодействия с водой. В зависимости… 1. Соль образована сильной кислотой и сильным основанием (NaCl, Ba(NO3)2). Такие соли гидролизу не подвержены. Раствор…Марка, выпушенная в Швеции в честь открытия явления электролитической диссоциации.
КРИСТАЛЛОГИДРАТЫ Некоторые ионы настолько прочно удерживают гидратную воду, что кристаллизуются…При переходе от кислой среды к щелочной окраска лакмуса меняется с красной на синюю.
Готовили лакмус из специальных видов лишайников. Измельчённые лишайники увлажняли, а затем добавляли в эту смесь золу и соду. Приготовленную… Похожее на орсейль красящее вещество было выделено в XVII в. из гелиотропа —… Знаменитый физик и химик XVII в. Роберт Бойль писал о гелиотропе: «Плоды этого растения дают сок, который при…Метиловый оранжевый в щелочной среде.
В XIX в. на смену лакмусу пришли более прочные и дешёвые синтетические красители, поэтому использование лакмуса ограничивается лишь грубым…При увеличении рН до 8—8,5 окраска фенолфталеина изменяется с бесцветной на малиновую.
В наши дни известны несколько сот кислотно-основных индикаторов, искусственно синтезированных начиная с середины XIX в. С некоторыми из них можно… Однако наиболее часто в лабораторной практике используется универсальный…Окраска универсального индикатора при различных значениях рН.
Интересно сравнить кислотность (щёлочность) растворов различных кислот, оснований и солей. Значение рН зависит от концентрации. Поэтому в таблице… Ещё большей кислотности можно добиться, добавив в магическую кислоту серный ангидрид SO3. Все эти смеси являются…СОЕДИНЕНИЯ В КВАДРАТНЫХ СКОБКАХ. КОМПЛЕКСЫ
В начале XVIII в. красильный мастер Дисбах в Берлине приобрёл у торговца необычный поташ (карбонат калия), растворы которого с солями железа… При взаимодействии жёлтой кровяной соли с солями железа(III) и образуется… При окислении K4[Fe(CN)6] хлором получается ещё одна «кровяная соль» — красная K3[Fe(CN)6], или гексацианоферрат(III)…Альфред Вернер.

Образование тетрахлорокупрата натрия Na2[CuCl4] при добавлении поваренной соли к раствору медного купороса.

Строение гидратных оболочек ионов в водных растворах.
Например, соль Пейроне, по Вернеру, имеет цис-строение (одинаковые лиганды — соседи), а соль Рейзе — транс-строение (соседствуют разные лиганды). … Второе наиболее распространённое координационное число — 6: лиганды… В дальнейшем Вернер продолжал совершенствовать свою теорию. Так, он признал, что между главной и побочной…– Конец работы –
Используемые теги: основы, химии0.06
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Основы Химии
Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов