Окраска универсального индикатора при различных значениях рН.
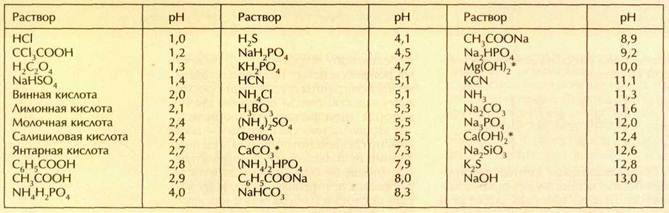
КАКОЙ РАСТВОР КИСЛЕЕ?
Интересно сравнить кислотность (щёлочность) растворов различных кислот, оснований и солей. Значение рН зависит от концентрации. Поэтому в таблице приведены значения рН водных растворов при концентрации 0,1 моль/л. Для малорастворимых соединений, отмеченных звёздочкой, указаны рН насыщенных растворов. Получается, что если выпить концентрированный лимонный сок, кислотность желудочного сока... понизится! Действительно, раствор лимонной кислоты лишь разбавит более сильную соляную кислоту, содержащуюся в желудочном соке.
Ещё большей кислотности можно добиться, добавив в магическую кислоту серный ангидрид SO3. Все эти смеси являются сверхкислотами — наиболее сильными из известных ныне доноров протонов. В растворах сверхкислот свойства оснований проявляют даже такие инертные вещества, как углеводороды. Например, в магической кислоте неопентан (2,2-диметилпропан) присоединяет ион водорода, превращаясь в метан и катион третичного бутила:

С—Н-КИСЛОТЫ
С—Н-кислотами называют органические вещества, в которых атомы водорода, связанные с атомом углерода, способны замешаться на металл. Например, заметные «кислотные» свойства проявляют углеводороды с тройной связью — ацетилен (С2Н2) и его производные. Так, ацетилен взаимодействует с металлическим натрием с образованием белого порошка аиетиленида натрия:
2СН=СН+2Na®2Н—СºС—Na+Н2.
Ещё более сильной С—Н-кислотой является трифенилметан (С6Н5)3СН — он реагирует даже с водным раствором щёлочи. Самая сильная из известных С—Н-кислот — цианпроизводное фуллерена: это примерно в 100 раз более сильная кислота, чем уксусная.