Вальтер Нернст.
бесполезно свою энергию и не оборвёт цепь. Механизм энергетических цепей, хотя и не подтвердился для данной реакции, оказался верным для других процессов — с участием фтора, открытых лишь полвека спустя!
В 1918 г. немецкий физикохимик, лауреат Нобелевской премии Вальтер Нернст предложил свой механизм этой реакции. Он предположил, что активными частицами являются атомы водорода и хлора:

(Неспаренный электрон часто обозначают точкой.) Обрыв цепей происходит, когда активные атомы Н или С1 реагируют с молекулами примеси, либо «прилипают» к стенке сосуда, либо взаимодействуют между собой (рекомбинируют), превращаясь в неактивные молекулы Н2 и Сl2. Схема Нернста была подтверждена разными экспериментами. Один из самых остроумных провёл английский физикохимик Майкл Поляни (1891 — 1976). В его опытах струя водорода проходила над слегка подогретым металлическим натрием и попадала в темноте в сосуд с хлором. Чистый водород с хлором при такой температуре не взаимодействует, но ничтожная примесь паров натрия полностью меняет дело: идёт быстрый
процесс образования хлороводорода. Здесь роль инициатора цепной реакции играет натрий: Na+Сl2®NaCl+Сl. Аналогичные результаты Поляни получил для реакции хлора с метаном. В этом случае стадии продолжения цепи выглядели так:
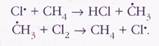
В рассмотренных цепных реакциях участвуют «осколки» исходных молекул — активные частицы — Н, Сl, СН3. Такие частицы, в которых один из электронов не имеет для себя пары, и потому обладающие очень высокой активностью, называются свободными радикалами. Впервые мысль об их существовании высказал ещё в 1900 г. американский химик-органик Мозес Гомберг (1866—1947), обнаруживший трифенилметильные радикалы (С6Н5)3С•, которые впоследствии были названы его именем.
После работ Гомберга естественно возник вопрос: является ли трифенилметил исключением, или в свободном состоянии могут существовать и другие «осколки» молекул, например метил СН3, или даже отдельные атомы — водорода, кислорода, серы и других элементов. Ответ на это дал в 1929 г. немецкий химик Фридрих Адольф Панет (1887— 1958), проведя со своим учеником Вильгельмом Хофедицем простой и красивый эксперимент. Газообразный азот под небольшим давлением пропускали через склянку, на дне которой находился тетраметилсвинец (СН3)4Рb — тяжёлая очень ядовитая жидкость. Азот насыщался её парами и с большой скоростью (от 12 до 16 м/с) проходил по длинной узкой трубке из жаростойкого кварцевого стекла; отдельные участки трубки могли нагреваться до температуры разложения тетраметилсвинца — приблизительно 450 °С. Далее азот увлекал продукты разложения в ловушку, охлаждаемую до очень низкой температуры.
При нагреве одного из участков трубки — в точке 1 — в течение 1 — 2 минут на внутренней поверхности
