рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- ББК 24.1
Реферат Курсовая Конспект
ББК 24.1
ББК 24.1 - раздел Химия, Сборник задач Д.Э.Чиркст, Т.Е.Литвинова, О.В.Черемисина, Н.Я.Дубровская, И.И.Иванов, Л.В.Григорьева Isbn 5-94211-216-9 ó Санкт...
| ISBN 5-94211-216-9 | Ó Санкт-Петербургский горный институт им. Г.В.Плеханова, 2003 г. |
| |
1. Основные классы неорганических соединений. Номенклатура
К основным классам неорганических соединений относятся оксиды, гидроксиды, кислоты, соли. Рассмотрим основы номенклатуры и характерные свойства каждого из этих классов соединений.
Оксиды. Оксидами называют соединения, состоящие из кислорода и какого-нибудь элемента El. Общую формулу оксидов можно записать как ElxOy, где х и y – наименьшие целые числа, кратные валентности кислорода и элемента соответственно, например,  .
.
Названия оксидов дают по следующей схеме:
Оксид _______________________________ (____________).
название элемента степень окисления элемента
Например, N2O – оксид азота (I), СО – оксид углерода (II), Fe2O3 – оксид железа (III), SO3 - оксид серы (VI).
По химическим свойствам оксиды делят на две группы: солеобразующие и несолеобразующие. Первой группе соответствуют соли, вторая группа (в нее входят СО, NO и др.) солей не образует. Солеобразующие оксиды подразделяют на основные, амфотерные и кислотные оксиды.
Основные оксиды образованы металлами и взаимодействуют с кислотами с образованием солей:
Fe2O3 + 6 HCl ® 2 FeCl3 + 3H2O.
Оксиды элементов I и II групп главных подгрупп периодической системы (за исключением бериллия и магния) взаимодействуют с водой с образованием соответствующих гидроксидов
CaO + H2O ® Ca(OH)2
и с кислотными оксидами с образованием солей
Na2O + CO2 ® Na2CO3.
Амфотерные оксиды также образованы металлами и обладают одновременно свойствами и основных, и кислотных оксидов. Отличительным признаком амфотерных оксидов является способность взаимодействовать как с кислотами, так и со щелочами с образованием солей:
ZnO + H2SO4 ® ZnSO4 + H2O;
ZnO + 2 KOH ® K2ZnO2 + H2O (при сплавлении);
ZnO + 2 KOH + H2O ® K2[Zn(OH)4] (в растворе).
Наиболее распространенными представителями амфотерных оксидов являются ZnO, Al2O3, Cr2O3.
Кислотные оксиды, в основном, образованы неметаллами (SO3, CO2), но некоторые высшие оксиды металлов тоже являются кислотными (например, CrO3, Mn2O7 и др.). Главный отличительный признак кислотных оксидов – их способность взаимодействовать со щелочами с образованием солей:
CO2 + 2 NaOH ® Na2CO3 + H2O,
CrO3 + 2 KOH ® K2CrO4 + H2O.
Газообразные кислотные оксиды взаимодействуют с водой с образованием соответствующих кислот
SO2 + H2O ® H2SO3.
Гидроксиды. Гидроксидами называют соединения, состоящие из положительного иона металла или иона аммония NH4+ и одной или нескольких гидроксогрупп (OH–). Общую формулу гидроксида можно записать как Me(OH)x, где х – степень окисления металла. Например, NaOH, Fe(OH)2, Al(OH)3.
Названия гидроксидов дают по следующей схеме:
Гидроксид_____________________________ (____________).
название металла степень окисления металла
Например, NaOH – гидроксид натрия, Fe(OH)2 – гидроксид железа (II), Al(OH)3 – гидроксид алюминия.
С точки зрения теории электролитической диссоциации, основания и щелочи способны диссоциировать в растворе с образованием гидроксид-ионов (OH–). По химическим свойствам гидроксиды делят на щелочные, основные и амфотерные гидроксиды.
Щелочные гидроксиды (щелочи) образованы элементами I и II группы главной подгруппы периодической системы элементов, за исключением бериллия и магния. Все щелочи, в отличие от остальных гидроксидов, растворимы в воде. Нерастворимые гидроксиды могут быть получены путем воздействия щелочей на соответствующие соли:
CuSO4 + 2 NaOH ® Na2SO4 + Cu(OH)2¯.
Все гидроксиды взаимодействуют с кислотами с образованием солей:
Fe(OH)3 + 3 HNO3 ® Fe(NO3)3 + 3 H2O;
Zn(OH)2 + 2 HCl ® ZnCl2 + H2O.
Амфотерныегидроксиды могут взаимодействовать как с кислотами, так и со щелочами, образуя соли. К амфотерным гидроксидам, в частности, относятся Be(OH)2, Zn(OH)2, Al(OH)3, Cr(OH)3. Реакция амфотерного гидроксида со щелочью в растворе и в расплаве идет по-разному. В растворе образуются гидроксокомплексы:
Zn(OH)2 + 2 NaOH ® Na2[Zn(OH)4],
в расплаве – обычные соли:
Zn(OH)2 + 2 NaOH ® Na2ZnO2 + Н2О.
Кислоты. Кислотами называют вещества, состоящие из отрицательного иона кислотного остатка и положительного иона водорода (одного или нескольких). Общую формулу кислоты можно записать в виде HxAn, где х – модуль заряда аниона кислотного остатка Anx-. С точки зрения теории электролитической диссоциации, к кислотам относятся вещества, способные диссоциировать в растворе с образованием ионов водорода.
По наличию атома кислорода в кислотном остатке различают бескислородные кислоты (HCl, H2S) и кислородсодержащие (HNO3, H2SO4).
По числу атомов водорода в молекуле кислоты, способных замещаться металлами, различают кислоты одноосновные (HCl, HNO3), двухосновные (H2S, H2SO4), трехосновные (H3PO4) и т.д.
Все кислоты взаимодействуют с гидроксидами металлов и с активными металлами с образованием солей:
H2SO3 + 2 NaOH ® Na2SO3 + H2O;
2 HCl + Zn ® ZnCl2 + H2.
При составлении названия кислот используется корень русского названия элемента, образующего кислоту (центрального атома), с добавлением суффикса, окончания или приставки в зависимости от состава кислоты и степени окисления центрального атома.
Бескислородные кислоты называют по схеме: элементоводородная кислота. Например, HCl – хлороводородная кислота (соляная), H2S – сероводородная кислота, H2Te – теллуроводородная кислота.
Кислородсодержащие кислоты получают название в зависимости от степени окисления центрального атома. При максимальной степени окисления (высшие кислоты) используют окончание -ная или -вая. Например, HNO3 – азотная кислота, H2SO4 – серная кислота, H2CrO4 – хромовая кислота. Если центральный атом имеет минимальную положительную степень окисления, используют суффикс -ист. Например, HNO2 – азотистая кислота, H2SO3 – сернистая кислота.
Для обозначения степеней окисления атомов галогенов используют следующие суффиксы: -н ® -оват ® -ист ® -оватист (степень окисления в ряду понижается). Например, HCl+7O4 – хлорная, HCl+5O3 – хлорноватая, HCl+3O2 – хлористая, HCl+O – хлорноватистая кислота.
Приставками орто- и мета- обозначают кислоты, образованные элементом с одинаковой степенью окисления и разной основностью. Например, H3PO4 – ортофосфорная кислота, HPO3 – метафосфорная кислота.
Если в молекуле кислоты атом кислорода замещен на серу со степенью окисления –2, в названии употребляют приставку тио-. Например, H2SO3S (H2S2O3) – тиосерная кислота, H2CS3 – тритиоугольная кислота.
Приставку ди- вводят для обозначения кислот с двумя атомами, образующими кислотный остаток. Например, H2P2O7 – дифосфорная кислота, H2Cr2O7 – дихромовая кислота.
Соли. Солями называют сложные вещества, состоящие из катиона металла и аниона кислотного остатка. Общую формулу соли можно записать как MexAny, где х и y – наименьшие целые числа, кратные зарядам катиона и аниона соответственно. Соли можно рассматривать как продукты полного или частичного замещения в молекуле кислоты атомов водорода атомами металлов или как продукт замещения гидроксогрупп в молекуле гидроксида металла кислотными остатками.
При полном замещении (нейтрализации) образуются средние соли:
2 NaOH + H2SO4 ® Na2SO4 + 2 H2O.
При неполной нейтрализации многоосновной кислоты гидроксидом металла образуются кислые соли:
H3PO4 + KOH ® KH2PO4 + H2O.
При неполной нейтрализации гидроксида металла кислотой образуются основные соли:
Fe(OH)3 + 2 HCl ® FeOHCl2 + 2 H2O.
Разновидностью основных солей являются оксосоли, образующиеся при отщеплении молекулы воды от основной соли:
Bi(OH)2Cl ® BiOCl + H2O.
В ряде случаев образуются двойные соли, имеющие два разных катиона металла и один кислотный остаток, например KAl(SO4)2.
Названия солей составляют из названия кислотного остатка и названия металла в родительном падеже; в скобках указывают степень окисления металла, если их несколько. Например, Fe2(SO4)3 - сульфат железа (III), NaCl – хлорид натрия. Название аниона соли дают, исходя из латинского корня кислотообразующего элемента, с добавлением приставки или суффикса в зависимости от наличия кислорода в кислотном остатке, степени окисления кислотообразующего элемента и состава кислотного остатка.
Кислотные остатки бескислородных кислот обозначают, добавляя к латинскому корню кислотообразующего элемента суффикс –ид. Например, Cl- - хлорид, NaCl – хлорид натрия; S2- - сульфид, NiS – сульфид никеля (II).
Кислотные остатки кислородсодержащих кислот называют, учитывая степень окисления. Если кислотообразующий элемент находится в высшей степени окисления, к латинскому корню кислотообразующего элемента добавляют суффикс –ат. Например, SO42- - сульфат, K2SO4 - сульфат калия; NO3- - нитрат, NH4NO3 - нитрат аммония; CrO42- - хромат, BaCrO4 - хромат бария.
Если кислотообразующий элемент находится в низшей степени окисления, к латинскому корню кислотообразующего элемента добавляют суффикс –ит. Например, SO32- - сульфит, BaSO3 - сульфит бария; NO2- - нитрит, NаNO3 - нитрит натрия; CrO2- - хромит, KCrO2 - хромит калия.
В обозначении анионов орто- и метакислот сохраняют приставки орто- и мета-. Например, PO43- - ортофосфат, Na3PO4 - ортофосфат натрия; PO3- - метафосфат, NaPO3 - метафосфат натрия. Названия кислотных остатков тиокислот имеют приставку тио-. Например, SSO32- (S2O32-) – тиосульфат, Na2S2O3 – тиосульфат натрия.
Если кислотный остаток содержит два атома кислотообразующего элемента, то к названию аниона добавляют приставку ди-. Например, Cr2O72- - дихромат, Na2Cr2O7 – дихромат натрия.
Для обозначения степеней окисления атомов галогенов используют следующие приставки и суффиксы: пер-….-ат ® -ат ® -ит ® гипо-…..-ит (степень окисления в ряду понижается). Например, Cl+7O4- – перхлорат, Cl+5O3- – хлорат, HCl+3O2- – хлорит, Cl+O- – гипохлорит.
Для названия анионов кислых солей используют приставку гидро-, количество атомов водорода в составе соли указывают греческими числительными (ди, три, тетра и т.д.). Например, HCO3- - гидрокарбонат, NaHCO3 – гидрокарбонат натрия, Ba(HCO3)2 – гидрокарбонат бария, H2PO4- - дигидроортофосфат, KH2PO4 - дигидроортофосфат калия.
Катионам основных солей дают названия с приставкой гидроксо-, количество гидроксогрупп в составе соли указывают греческими числительными (ди, три, тетра и т.д.). Например, FeOHCl – хлорид гидроксожелеза (II), (NiOH)2SO4 - сульфат гидроксоникеля, Al(OH)2NO3 - нитрат дигидроксоалюминия.
Для названия катионов оксосолей используют корень латинского названия металла с добавлением суффикса –ил. Например, BiO+ - висмутил, BiOCl – хлорид висмутила; UO22+ - уранил, UO2Cl2 – хлорид уранила.
Название двойным солям дают, руководствуясь вышеперечисленными правилами, называя сначала анион, а затем катионы в направлении справа налево. Например, KAl(SO4)2 – сульфат алюминия, калия.
Для солей характерны реакции с кислотами, щелочами, металлами, друг с другом, если в результате реакции образуются осадок, газ или малодиссоциированное соединение. Следует помнить, что более сильная кислота вытесняет более слабую из состава соли, более активный металл замещает менее активный, при действии на соли щелочей могут получаться осадки нерастворимых гидроксидов металлов.
Задание I. по названию вещества написать его формулу.
| 1. Азотистая кислота. | 14. Вольфрамат цезия. |
| 2. Азотная кислота. | 15. Вольфрамовая кислота. |
| 3. ацетат гидроксосвинца (II). | 16. Германат кальция. |
| 4. Ацетат натрия. | 17. Гидрокарбонат калия. |
| 5. Ацетат свинца (II). | 18. Гидрокарбонат кальция. |
| 6. Бериллат натрия. | 19. Гидроксид алюминия. |
| 7. Бромат серебра. | 20. Гидросульфат лития. |
| 8. Бромид алюминия. | 21. Гидросульфат марганца (II). |
| 9. Бромид кобальта (II). | 22. Гидросульфид натрия. |
| 10. Бромноватая кислота. | 23. Гидросульфит лития. |
| 11. Бромноватистая кислота. | 24. Гидротеллурид калия. |
| 12. Бромоводородная кислота. | 25. Гидрофосфат цинка. |
| 13. Висмутат натрия. | 26. Гидродихромат калия. |
| 27. Гидродихромат натрия. | 68. Нитрат гидроксокобальта (II). |
| 28. Гипобромит стронция. | 69. Нитрат гидроксохрома (III). |
| 29. Гипоиодит магния. | 70. Нитрат кобальта (III). |
| 30. Гипохлорит кальция. | 71. Нитрат свинца (IV). |
| 31. Дисерная кислота. | 72. Нитрит калия. |
| 32. Дифосфорная кислота. | 73. Нитрит магния. |
| 33. Дихромовая кислота. | 74. Оксалат аммония. |
| 34. Дигидростибиат калия. | 75. Ортоарсенат калия. |
| 35. Дигидростибиат натрия. | 76. Ортоборат калия. |
| 36. Дисульфат аммония. | 77. Плюмбат свинца (II). |
| 37. Дифосфат кальция. | 78. Ортосиликат алюминия. |
| 38. Дихромат аммония. | 79. Ортофосфат бария. |
| 39. Дихромат алюминия. | 80. Ортофосфат гидроксоталлия (III). |
| 40. Дихромат калия. | 81. Ортофосфат дигидроксохрома (III). |
| 41. Иодат бария. | 82. Ортофосфористая кислота. |
| 42. Иодид гидроксосвинца (II). | 83. Периодат бария. |
| 43. Иодид кадмия. | 84. Перманганат калия. |
| 44. Иодид кобальта (II). | 85. Перманганат магния. |
| 45. Иодид сурьмы. | 86. Перманганат натрия. |
| 46. Иодная кислота. | 87. Перренат натрия. |
| 47. Иодноватая кислота. | 88. Перхлорат лития. |
| 48. Иодноватистая кислота. | 89. Роданид калия. |
| 49. Карбонат гидроксомагния. | 90. Селенат лития. |
| 50. Карбонат гидроксомеди (II). | 91. Селеноводородная кислота. |
| 51. Карбонат калия. | 92. Сернистая кислота. |
| 52. Перманганат магния. | 93. Сульфат аммония. |
| 53. Метаалюминат натрия. | 94. Сульфат бария. |
| 54. Метаарсенат калия. | 95. Сульфат гидроксожелеза (II). |
| 55. Метаборат натрия. | 96. Сульфат гидроксожелеза (III). |
| 56. Висмутат аммония. | 97. Сульфат гидроксохрома (III). |
| 57. Висмутат стронция. | 98. Сульфат дигидроксохрома (III). |
| 58. Метаниобат калия. | 99. Сульфат железа (III). |
| 59. Оловянная кислота. | 100. Сульфат ртути (I). |
| 60. Станнат аммония. | 101. Сульфат ртути (II). |
| 61. Метафосфат дигидроксохрома (III). | 102. Сульфат свинца (IV). |
| 62. Метафосфат натрия. | 103. Сульфид свинца (II). |
| 63. Метафосфорная кислота. | 104. Теллурат кобальта (III). |
| 64. Молибдат аммония. | 105. Теллурид кальция. |
| 65. Молибденовая кислота. | 106. Тиокарбонат натрия. |
| 66. Ниобат калия. | 107. Тиосульфат натрия. |
| 67. Нитрат бария. | 108. Тиоугольная кислота. |
| 109. Тритиоугольная кислота. | 122. Хлорид калия. |
| 110. Угольная кислота. | 123. Хлорид олова (II). |
| 111. Уксусная кислота. | 124. Хлорид хрома (III). |
| 112. Формиат серебра. | 125. Хлорит железа (II). |
| 113. Фторид водорода. | 126. Хлорит калия. |
| 114. Фторид кислорода. | 127. Хлорит магния. |
| 115. Фтороводородная кислота. | 128. Хлорная кислота. |
| 116. Хлорат кальция. | 129. Хлорноватистая кислота. |
| 117. Хлорид висмута. | 130. Хромат гидроксоцинка. |
| 118. Хлорид гидроксокальция. | 131. Хромит железа (II). |
| 119. Хлорид железа (III). | 132. Хромит калия. |
| 120. Хлорид меди (II). | 133. Цианид калия. |
| 121. Хлорид натрия. | 134. Цинкат натрия. |
Задание II. Назвать соединения.
| 135. (CdOH)3PO4. | 158. BiCl3. |
| 136. (CuOH)2CO3. | 159. Ca(BiO3)2. |
| 137. (MgOH)2CO3. | 160. Ca(ClO)2. |
| 138. (NH4)2C2O4. | 161. Ca(ClO3)2. |
| 139. (NH4)2Cr2O7. | 162. Ca(HCO3)2. |
| 140. Na2Cr2O7. | 163. Ca2P2O7. |
| 141. (NH4)2SnO3. | 164. CaOHCl. |
| 142. (NH4)2SO4. | 165. Ca(H2PO4)2. |
| 143. (ZnOH)2CrO4. | 166. CaCrO4. |
| 144. [Cr(OH)2]2SO4. | 167. CaC2O4. |
| 145. [Cr(OH)2]3PO4. | 168. CaTe. |
| 146. Al(OH)3. | 169. CdI2. |
| 147. AlOHSO4. | 170. Cd(HS)2. |
| 148. Al(OH)2NO3. | 171. CH3COOH. |
| 149. AlBr3. | 172. Co(NO3)3. |
| 150. BaCrO4. | 173. CoBr2. |
| 151. BaCr2O7. | 174. CoI2. |
| 152. Ba(HSO3)2. | 175. CoTe. |
| 153. Ba(IO3)2. | 176. Cr(H2PO4)3. |
| 154. Ba(NO3)2. | 177. CrCl3. |
| 155. Ba3(PO4)2. | 178. CrOHSO4. |
| 156. BaSO3. | 179. CuCl2. |
| 157. BaSO4. | 180. OF2. |
| 181. Fe(ClO2)2. | 219. Na2CrO4. |
| 182. Fe(CrO2)2. | 220. KHTe. |
| 183. Fe(HCO3)3. | 221. K2MnO4. |
| 184. Fe2(SO4)3. | 222. K2H2P2O7. |
| 185. FeCl3. | 223. KMnO4. |
| 186. FeOHSO4. | 224. KNbO3. |
| 187. [Fe(OH)2]2SO4. | 225. KNO2. |
| 188. H2CrO4. | 226. Li2SeO4. |
| 189. H2CSO2. | 227. LiClO4. |
| 190. H2O. | 228. LiHSO4. |
| 191. H2Se. | 229. Mg(IO)2. |
| 192. H2SnO3. | 230. MgMnO4. |
| 193. H2SO3. | 231. Mn(HSO4)2. |
| 194. H2SO4. | 232. Na2BeO2. |
| 195. H2S2O3. | 233. Na2S2O3. |
| 196. H2S2O8. | 234. NaH2SbO4. |
| 197. H2WO4. | 235. NaAlO2. |
| 198. H3PO3. | 236. NaAlSiO4. |
| 199. HClO. | 237. Na3BO3. |
| 200. HClO3. | 238. NaCl. |
| 201. HClO4. | 239. Na2CrO4. |
| 202. HF. | 240. NaHS. |
| 203. HgSO4. | 241. NaMnO4. |
| 204. Hg2Cl2. | 242. Pb(SO4)2. |
| 205. HIO3. | 243. Pb3O4. |
| 206. HNO2. | 244. Pb(OH)CH3COO. |
| 207. H3PO3. | 245. Pb(OH)I. |
| 208. HPO3. | 246. PbS. |
| 209. K2CO3. | 247. SbI3. |
| 210. K2CrO4. | 248. Sn(NO3)4. |
| 211. K2Cr2O7. | 249. SnCl2. |
| 212. K3AsO4. | 250. Sr(BiO3)2. |
| 213. K3BO3. | 251. CrOH(NO3)2. |
| 214. KAsO3. | 252. SbONO3. |
| 215. KClO2. | 253. ZrOCl2. |
| 216. KCN. | 254. UO2(NO3)2. |
| 217. KCNS. | 255. NaUO2(CH3COO)3. |
| 218. KCrO2. |
Задание III. Написать в молекулярной и ионно-молекулярной формах уравнения реакций.
256. Нитрат свинца (II) + иодид калия.
257. Сульфид калия + серная кислота.
258. Карбонат калия + соляная кислота.
259. сульфат меди (II) + гидроксид натрия.
260. карбонат кальция + соляная кислота.
261. сульфит натрия + серная кислота.
262. бромид алюминия + нитрат серебра.
263. сульфид натрия + серная кислота.
264. сульфид железа (II) + соляная кислота.
265. формиат калия + азотная кислота.
266. хлорид аммония + гидроксид кальция.
267. соляная кислота + гидроксид бария.
268. плавиковая кислота + гидроксид калия.
269. гидроксид железа (III) + азотная кислота.
270. уксусная кислота + гидроксид аммония.
271. азотистая кислота + гидроксид аммония.
272. сероводород + гидроксид аммония.
273. гидрокарбонат натрия + соляная кислота.
274. хлорид железа (III) + гидроксид калия.
275. ацетат свинца + сульфат натрия.
276. гидросульфат калия + серная кислота.
277. нитрат цинка + избыток гидроксида натрия.
278. гидроксид кальция + оксид углерода (IV).
279. нитрат бария + сульфат натрия.
280. хлорид бария + сульфат алюминия.
281. нитрат свинца + сульфат железа (III).
282. сульфат хрома (III) + гидроксид аммония.
283. карбонат натрия + ортофосфорная кислота.
284. Нитрат дигидроксовисмута + азотная кислота.
285. Хлорид гидроксомагния + соляная кислота.
Задание IV. Cоставить молекулярные уравнения реакций, которым соответствуют ионно-молекулярные уравнения.
| 286. H+ + OH- ® H2O. | 291. SO32- + 2 H+ ® SO2 + H2O. |
| 287. Pb2+ + S2- ® PbS¯. | 292. Pb2+ + CrO42- ® PbCrO4¯. |
| 288. ClO- + H+ ® HClO. | 293. HCO3- + OH- ® CO32- + H2O. |
| 289. CO32- + 2H+ ® CO2 + H2O. | 294. ZnOH+ + H+ ® Zn2+ + H2O. |
| 290. CH3COOH + OH- ® CH3COO- + H2O. | 295. Mg2+ + CO32- ® MgCO3¯. |
| 296. Cu2+ + S2- ® CuS¯. | 306. HCO3- + H+ ® H2O + CO2. |
| 297. SiO32- + 2 H+ ® H2SiO3. | 307. Cu2+ + 2OH- ® Cu(OH)2¯. |
| 298. CaCO3 + 2H+ ® Ca2+ + H2O. | 308. Pb2+ + 2 I- ® PbI2¯. |
| 299. Al(OH)3 + OH- ® [Al(OH)4]-. | 309. Sr2+ + SO42- ® SrSO4¯. |
| 300. Pb2+ + 2 I- ® PbI2¯. | 310. Sr2+ + CO32- ® SrCO3¯. |
| 301. Fe(OH)3 + 3H+ ® Fe3+ + 3H2O. | 311. 2Ag+ + SO42- ® Ag2SO4¯. |
| 302. Cd2+ + 2OH- ® Cd(OH)2¯. | 312. Ba2+ + CO32- ® BaCO3¯. |
| 303. H+ + NO2- ® HNO2. | 313. Cd2+ + 2 OH- ® Cd(OH)2¯. |
| 304. Zn2+ + H2S ® ZnS¯ + 2 H+. | 314. CuOH+ + H+® Cu2+ + H2O. |
| 305. Ag+ + Cl- ® AgCl¯. | 315. NH4+ + OH- ® NH4OH. |
Задание V. Закончить и уравнять реакцию.
| 316. AgNO3 + H2S ® … | 340. CdCl2 + H2S ® … |
| 317. AgNO3 + K2Cr2O7 ® … | 341. CH3COOAg + H2S ® … |
| 318. AgNO3 + K2CrO4 ® … | 342. CH3COOH + Ba(OH)2 ® ... |
| 319. Al(OH)3 + H2SO4 ® … | 343. CH3COOH + NH4OH ® |
| 320. Al2(SO4)3 + AgNO3 ® … | 344. CH3COOK + H2SO4 ® … |
| 321. AlBr3 + AgNO3 ® … | 345. HCOOK + H2SO4 ® … |
| 322. AlI3 + AgNO3 ® … | 346. CH3COOPb + Na2CrO4 ® … |
| 323. Ba(NO3)2 + Cr2(SO4)3 ® … | 347. CH3COOPb + Na2SO4 ® … |
| 324. Ba(NO3)2 + K2CrO4 ® … | 348. Cr2(SO4)3 + NaOH ® … |
| 325. Ba(NO3)2 + Na2SO4 ® … | 349. Cr2(SO4)3 + NH4OH ® … |
| 326. Ba(OH)2 + CO2 ® … | 350. Cu(NO3)2 + Ba(OH)2 ® … |
| 327. BaCl2 + Al2(SO4)3 ® ... | 351. Cu(NO3)2 + H2S ® … |
| 328. BaCl2 + Na3PO4 ® … | 352. Cu(NO3)2 + Na2S ® … |
| 329. BaCl2 + CH3COOAg ® ... | 353. CuSO4 + NaOH ® … |
| 330. Bi(OH)(NO3)2 + HNO3 ® … | 354. CuSO4 + NH4OH ® … |
| 331. Ca(NO3)2 + H2C2O4 ® … | 355. CuSO4 + Ba(OH)2 ® … |
| 332. Ca(NO3)2 + Na2SO4 ® … | 356. Fe(OH)3 + H2SO4 ® … |
| 333. Ca(NO3)2 + Na3PO4 ® … | 357. Fe2(SO4)3 + NaOH ® … |
| 334. Ca(OH)2 + CO2 ® … | 358. FeCl3 + KOH ® … |
| 335. CaCl2 + H2SO4 ® … | 359. FeOHCl2 + HCl ® ... |
| 336. CaCO3 + CH3COOH ® … | 360. FeS + HCl ® … |
| 337. CaCO3 + HCl ® … | 361. H2S + NH4OH ® ... |
| 338. CaCO3 + CO2 + H2O ® ... | 362. HCOOK + HNO3 ® ... |
| 339. Cd(NO3)2 + Na2S ® … | 363. HF + KOH ® … |
| 364. Hg(NO3)2 + H2S ® ... | 385. Na2HPO4 + NaOH ® … |
| 365. HNO2 + NH4OH ® … | 386. NaHSO4 + NaOH ® … |
| 366. K2CO3 + H3PO4 ® … | 387. NaHSO4 + Ba(NO3)2 ® ... |
| 367. K2CO3 + HCl ® … | 388. NaOH + H2SO3 ® … |
| 368. KHSO3 + H2SO4 ® ... | 389. NaOH + H2SO4 ® … |
| 369. KOH + HCN ® … | 390. NH4Cl + Ca(OH)2 ® ... |
| 370. KOH + H3PO4 ® … | 391. NH4Cl + NaOH ® … |
| 371. Mg(NO3)2 + (NH4)2C2O4 ® ... | 392. NH4Cl + Sr(OH)2 ® … |
| 372. MgCO3 + HCl ® … | 393. NH4Cl + Ba(OH)2 ® … |
| 373. MgOHCl + HCl ® . | 394. Ni(NO3)2 + KOH ® … |
| 374. MnCl2 + NH4OH ® … | 395. NiSO4 + (NH4)2S ® … |
| 375. Na2S + H2SO4 ® … | 396. Pb(NO3)2 + Fe2(SO4)3 ® … |
| 376. Na2S + NiSO4 ® … | 397. Pb(NO3)2 + K2CrO4 ® … |
| 377. Na2S + CdSO4 ® … | 398. Pb(NO3)2 + KI ® … |
| 378. Na2SiO3 + H2SO4 ® … | 399. Pb(NO3)2 + Na2S ® ... |
| 379. Na2SO4 + BaCl2 ® … | 400. Pb(NO3)2 + NaCl ® … |
| 380. Na2SO4 + H2SO4 ® … | 401. Sr(NO3)2 + H2SO4 ® ... |
| 381. Na2SO4 + Pb(NO3)2 ® ... | 402. Zn(NO3)2 + KOH ® … |
| 382. Na2SO4 + BaCl2 ® … | 403. Zn(OH)2 + H2SO4 ® … |
| 383. NaHCO3 + HCl ® … | 404. Zn(OH)2 + NaOH(избыток) ® ... |
| 384. NaHCO3 + NaOH ® ... | 405. Zn(OH)2 + NaOH ® … |
2. Строение атома
Атом любого элемента состоит из положительно заряженного ядра и отрицательно заряженных электронов, в целом атом – система электронейтральная. Заряд ядра равен порядковому номеру элемента в таблице Д.И.Менделеева. Состояние электрона в атоме описывается при помощи набора четырех квантовых чисел: главного n, орбитального l, магнитного ml и спинового ms. Определенные значения трех квантовых чисел (n, l,ml) описывают состояние электрона, называемое атомной орбиталью (АО).
Главное квантовое число n определяет энергию АО и номер энергетического уровня, на котором находится электрон, и может принимать целочисленные значения от единицы до бесконечности.
Орбитальное квантовое число l определяет форму АО и энергетический подуровень, оно может принимать значения от нуля до n-1. Исторически атомным орбиталям со значениями l, равным 0, 1, 2, 3 присвоены буквенные обозначения s-, p-, d-, f-. В графических схемах электронного строения атомов каждая орбиталь обозначается символом .
 Магнитное квантовое число ml определяет пространственную ориентацию АО и отчасти ее форму, оно может принимать значения от –l до +l.
Магнитное квантовое число ml определяет пространственную ориентацию АО и отчасти ее форму, оно может принимать значения от –l до +l.
Спиновое квантовое число ms характеризует собственный момент импульса и связанный с ним магнитный момент и может принимать значения ±1/2.
Последовательность распределения электронов в атоме по мере увеличения значений l и n выражается электронными или электронно-графическими формулами.
При заполнении АО действует принцип Паули, из которого следует, что в атоме не может быть двух электронов, характеризующихся одинаковым набором значений четырех квантовых чисел. Состояние электронов в атоме должно отличаться значением хотя бы одного квантового числа.
Заполнение энергетических подуровней подчиняется правилу Хунда, согласно которому электроны в основном состоянии в атоме располагаются так, чтобы модуль суммарного спина всех электронов подуровня был максимальным. Например, четыре валентных p-электрона атома кислорода размещаются в квантовых ячейках следующим образом:


Последовательность заполнения энергетических уровней и подуровней в атомах выражается правилом Клечковкого: порядок заполнения определяется возрастанием суммы n+l, а при одинаковом ее значении первым заполняется подуровень с меньшим значением n в этой сумме. Например,
1s®2s®2p®3s®3p®4s®3d®4p®5s®4d®5p®6s®5d1(La)®4f
(лантаноиды)®5d®6p®7s®6d1(Ac)®5f(актиноиды)®6d®…
Принадлежность элемента к электронному семейству определяется характером заполнения энергетических подуровней: s-элементы – заполнение внешнего s-подуровня (например, литий 1s22s1), р-элементы – заполнение внешнего p-подуровня (например, фтор – 1s22s22p5), d-элементы – заполнение предвнешнего d-подуровня (например, ванадий – 1s2 2s2 2p6 3s2 3p6 4s2 3d3), f-элементы – заполнение f-подуровня второго снаружи уровня (например,  неодим – 1s2 2s2 2p2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f4).
неодим – 1s2 2s2 2p2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f4).
Для d- и f-элементов возможны отклонения от описанного способа заполнения АО – так называемый провал электрона. Это явление связано с тем, что для атома устойчивым состоянием является полностью или наполовину заполненная АО, т.е. d10, d5, f14, f7. В ситуации, когда до достижения такого состояния не хватает одного электрона, он переходит («проваливается») с предыдущего уровня. Например, электронный паспорт серебра 1s22s22p63s23p64s23d104p65s24d9 с учетом провала электрона примет вид 1s22s22p63s23p64s23d104p65s14d10.
Если на валентных энергетических уровнях имеются вакантные АО, то при получении электронами порции энергии (возбуждении атома) становится возможным «разъединение» валентных электронов, т.е. их переходы с тех подуровней, где все АО заняты полностью (¯) или частично (), на другие валентные подуровни того же уровня, имеющие незаполненные АО. При этом с тех АО, которые в основном (соответствующем минимальной энергии атома) состоянии были заняты полностью, «уходит» по одному электрону последовательно, т.е. возможно несколько возбужденных состояний. Возбуждение меняет валентное состояние атома (число его неспаренных электронов).
Пример 1. Составить электронную формулу атома брома и графическую схему заполнения электронами валентных орбиталей в нормальном и возбужденном состояниях.
Решение. 1. Порядковый номер брома – 35, следовательно атом брома имеет 35 электронов. Бром находится в IV периоде периодической системы, следовательно, АО с n, равным 1; 2 и 3 заполнены полностью. Бром относится к p-элементам, следовательно, заполнен 4s-подуровень. В ряду 4p-элементов бром – пятый элемент, следовательно, на 4p-подуровне – пять электронов. Таким образом, электронная формула брома имеет вид 1s22s22p63s23p64s23d104p5.
2. Валентными орбиталями в этом атоме являются орбитали внешнего (четвертого) электронного слоя, т.е. 4s-, 4p- и незаполненные 4d-орбитали. Графически схема заполнения электронами этих орбиталей имеет вид
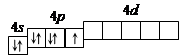 |

в таком состоянии бром имеет валентность 1, которой соответствуют степени окисления -1 и +1.
3. При затрате некоторой энергии спаренный p-электрон перейдет на свободную d-орбиталь. В этом первом возбужденном состоянии
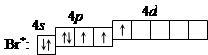 |

бром имеет валентность 3, которой соответствует степень окисления +3.
4. При передаче атому брома еще некоторого количества энергии следующий p-электрон также перейдет на свободную d-орбиталь. Во втором возбужденном состоянии
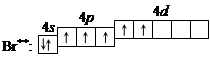 |

бром имеет валентность 5, которой соответствует степень окисления +5.
5. При передаче атому брома еще некоторого количества энергии s-электрон также перейдет на свободную d-орбиталь. В третьем возбужденном состоянии
 |

бром имеет валентность 7, которой соответствует степень окисления +7.
Пример 2. Составить электронные формулы атома селена в состояниях Se-2 и Se+4 и графические схемы заполнения электронами валентных орбиталей.
Решение. 1. Cоставим электронную формулу атома селена (см. пример 1): 1s22s22p63s23p64s23d104p4. Графическая схема заполнения электронами валентных орбиталей имеет вид
 |


2. Для получения Se-2 необходимо к атому селена добавить два электрона на 4p-орбиталь (согласно правилу Клечковского). Тогда графическая схема примет вид
 |

Электронная формула Se-2 – 1s22s22p63s23p64s23d104p6.
3. Для получения Se+4 необходимо убрать четыре электрона с 4p-орбитали, атома селена:
 |

Электронная формула Se+4 – 1s22s22p63s23p64s23d104p0.
Пример 3. Составить полную электронную формулу элемента, валентные электроны которого имеют конфигурацию 3d6, определить, к какому периоду таблицы Д.И.Менделеева принадлежит данный элемент.
Решение. Согласно правилу Клечковского 3d-элементы находятся в четвертом периоде таблицы Д.И.Менделеева. На данной орбитали находится шесть электронов, значит, это шестой по счету среди 3d-элементов, т.е. железо, полная электронная формула которого 1s22s22p63s23p64s23d6.
Задание I. Составить электронные формулы элементов, графические схемы заполнения электронами валентных орбиталей в спокойном и возбужденном состояниях, указать, к какому типу эти элементы относятся.
| 1. B, Al, Th. 2. Po, Ba, Lu. 3. Mg, Pm, Be. 4. Br, Co, Hf. 5. C, Tm, As. 6. Nd, Ca, V. 7. Ta, O, Ce. 8. Y, Rb, S. | 9. At, Xe, Lr. 10. Cs, U, H. 11. Cl, Cu, Bi. 12. Na, Ac, Fe. 13. Pb, Ra, Dy. 14. Ag, Re, In. 15. Cd, K, Pa. 16. P, Se, Li. | 17. Yb, Mn, Sn. 18. Mo, La, N. 19. Pu, Ni, Sb. 20. Au, Np, Rn. 21. Cr, Tl, Cm. 22. Si, I, Zr. 23. Tb, Sr, Bk. 24. Fr, Ti, W. | 25. He, Hg, Gd. 26. Pt, Ne, Sm. 27. Ga, Ru, Ho. 28. Sc, Pr, Os. 29. Ar, Ir, Eu. 30. Zn, Rh, Er. 31. Kr, Pd, Am. 32. Ge, Cf, F. |
Задание II. Составить электронные формулы атомов в указанных состояниях и графические схемы заполнения электронами валентных орбиталей.
| 33. Li+, C+2. 34. O-2, F-. 35. Na+, N-3. 36. Ca+2, C+4. 37. Al+3, B-3. 38. C-4, Ba+2. 39. S+6, P-3. 40. P+5, Cl-1. | 41. I+5, Fe+3. 42. Be+2, Co+3. 43. Cr+6, Cu+2. 44. I-, P+3. 45. Cr+3, Br+3. 46. Ag+, Sn+4. 47. Zn+2, S-2. 48. K+, Fe+2. | 49. Zr+4, Pb+2. 50. N+5, Br-. 51. Ni+2, Cl+5. 52. Se-2, Cs+. 53. Te-2, Sr+2. 54. Bi+3, Si-4. 55. B+3, Sc+2. 56. Mg+2, Mn+7. | 57. Cd+2, Sn+2. 58. Nb+3, Hg+. 59. Tl+, V+3. 60. Ti+4, Mn+2. 61. Os+3, Au+3. 62. Rb+, Ce+3. 63. Fr+1, Y+3. 64. H+, Re+7. |
Задание III. Исходя из состояния валентных электронов, составить электронную формулу элемента в нулевой степени окисления. Определить, к какому периоду таблицы Д.И.Менделеева принадлежит данный элемент.
| 65. 4d1. 66. 3d10. 67. 4s13d10. 68. 5d2. 69. 6p2. 70. 6s14f145d10. 71. 4s23d5. 72. 4s13d5. | 73. 7s26d1. 74. 5d3. 75. 6s24f2. 76. 6p1. 77. 5s14d5. 78. 4f3. 79. 6d15f3. 80. 5s24d5. | 81. 5d8. 82. 5s14d10. 83. 5s24d10. 84. 5s2. 85. 5p3. 86. 6p4. 87. 4d6. 88. 5d6. | 89. 5f7. 90. 5d6. 91. 5f2. 92. 4d7. 93. 5d14f7. 94. 4f10. 95. 4d8. 96. 5p6. |
3. Основные понятия и законы химии
Моль, молярная масса.Известно, что любое вещество состоит из атомов, химические процессы протекают благодаря взаимодействию атомов. Из практических соображений было введено понятие моля. Условились считать, что 1 моль вещества содержит 6,02×1023 частиц, любых – атомов, молекул, ионов. Число 6,02×1023 называется числом Авогадро. Математически понятие моля можно записать в виде формулы
 ,
,
где n – количество вещества, моль; N – число частиц (молекул, атомов, ионов); NA – число Авогадро.
Массу 1 моль вещества называют молярной массой M. Молярная масса в неорганической химии является характеристикой вещества, непосредственно связанной с его количественным составом и численно равна молекулярной массе (массе одной молекулы) вещества, выраженной в углеродных единицах. Молярная масса любого вещества
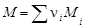 ,
,
где ni – стехиометрический индекс в формуле вещества; Мi – молярная масса элемента, входящего в соединение, г/моль (см. таблицу элементов Д.И.Менделеева).
Масса и количество вещества связаны зависимостью
 .
.
Молярная масса вещества может быть определена экспериментально. Для газов ее находят, например, по относительной плотности газа D, которая представляет собой соотношение молярных масс двух газов, одна из которых обычно известна:
 .
.
Наиболее часто используют плотность газа по воздуху Dвозд, тогда М2 = МвоздDвозд (Мвозд = 29 г/моль), или по водороду 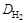 , тогда М2 =
, тогда М2 = 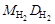 .
.
Основные газовые законы.Состояние газа характеризуется его температурой, давлением и объемом. Если температура газа 0 °С (273,15 K), а давление 1 атм (1,013×105 Па = 760 мм рт. ст.), то условия, при которых находится газ, называют нормальными.
Взаимосвязь между объемом и количеством вещества газа описывается законом Авогадро: в равных объемах любых газов, взятых при одной и той же температуре и одинаковом давлении, содержится одинаковое число молекул. Следовательно, при одинаковых условиях 1 моль любого газа занимает один и тот же объем. Этот объем называется молярным объемом газа VM. При нормальных условиях VM = 22,4 л и количество вещества газа в молях может быть вычислено по уравнению
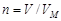 .
.
Взаимосвязь между количеством вещества, температурой, давлением и объемом газа устанавливает уравнение Менделеева – Клапейрона:
 ,
,
где P – давление, Па; V – объем, м3; n – количество вещества, моль; m – масса, г; М – молярная масса газа, г/моль; R – универсальная газовая постоянная, в системе СИ R = 8,314 Дж/(моль×K).
На практике чаще всего приходится иметь дело со смесью газов. Каждый газ вносит свой вклад в общее давление системы – парциальное давление. Парциальным называется давление, которое производил бы этот газ, занимая при тех же физических условиях объем всей газовой смеси. Парциальное давление может быть вычислено через объемное содержание газа в газовой смеси или через мольную долю газа. Соответственно
 ;
; 
где Vi – объем данного газа; SVi – общий объем газовой смеси; ni – количество вещества данного газа; Sni – сумма числа молей всех компонентов газовой смеси; xi – мольная доля газа, 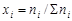 ; P – общее давление смеси газов.
; P – общее давление смеси газов.
Общее давление смеси газов, не вступающих друг с другом в химическое взаимодействие, равно сумме парциальных давлений газов, составляющих данную смесь:
P = Spi.
Если газ собран над жидкостью, то при расчетах его парциального давления следует иметь в виду, что оно равно разности общего давления и парциального давления пара жидкости. Например, для газа, собранного над водой,
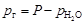 .
.
Закон эквивалентов.Эквивалентом вещества называется такое его количество, которое соединяется с 1 моль атомов водорода или замещает то же количество атомов водорода в химических реакциях. Эквивалентной массой Э называется масса одного эквивалента вещества. Эквивалентнымобъемом газа называется объем, занимаемый при данных условиях одним эквивалентом вещества. Эквивалент (эквивалентную массу) можно вычислить по составу соединения данного элемента с любым другим, эквивалент (эквивалентная масса) которого известен, по законуэквивалентов: массы взаимодействующих веществ A + B ® C + D пропорциональны их эквивалентным массам:
 .
.
На основе закона эквивалентов можно вычислить эквивалентную массу вещества:
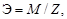
где М – молярная масса элемента, оксида, кислоты, основания или соли, г/моль; Z – степень окисления элемента в продукте реакции, произведение числа атомов элемента и степени окисления элемента в оксидах, основность кислоты, кислотность основания, произведение числа атомов металла и степени окисления металла в соли.
Пример 1. Определить массовую долю алюминия в его оксиде и вычислить, сколько алюминия теоретически можно выделить из 15 т боксита с содержанием Al2O3 87 %.
Решение. Найдем молярную массу Al2O3:
 .
.
Примем количество вещества Al2O3 равным 1 моль, тогда количество вещества алюминия будет равно 2 моль. Масса оксида алюминия составит 102 г, а масса алюминия 2×27 = 54 г. Вычислим массовую долю алюминия в его оксиде:
 .
.
Вычислим массу чистого Al2O3 в боксите и массу алюминия, которую можно получить из 15 т боксита:
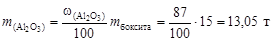 ;
;
 .
.
Пример 2. При прокаливании 10 г некоторого вещества было получено 6,436 г CuO и 3,564 г CO2. Записать формулу соединения.
Решение. 1. Найдем количество вещества оксида меди (II):

В 1 моль CuO содержится по 1 моль Cu и О, следовательно n(Cu) = = n(O, CuO) = 0,081 моль.
2. Найдем количество вещества оксида углерода (IV):

В 1 моль CO2 содержится 1 моль C и 2 моль О, следовательно n(C) = 0,081 моль, 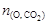 = 2×0,081 = 0,162 моль.
= 2×0,081 = 0,162 моль.
3. Общее количество вещества кислорода n(O) = 0,081 + + 0,162 = 0,243 моль.
4. Запишем соотношение количества вещества элементов:
n(Cu):n(C):n(O) = 0,081:0,081:0,243 = 1:1:(0,243/0,081) = 1:1:3.
Полученные целые числа представляют собой стехиометрические индексы формулы вещества. Следовательно, химическая формула искомого вещества CuCO3.
Пример 3.Соединение серы с фтором содержит 62,8 % серы и 37,2 % фтора. Данное соединение при объеме 118 мл в газообразном состоянии (температура 7 °С, давление 96,34 кПа) имеет массу 0,51 г. Какова истинная формула соединения?
Решение. 1. Рассчитаем истинную молярную массу соединения по уравнению Менделеева – Клапейрона:
 .
.
2. Пусть x и y – количество атомов соответственно серы и фтора в молекуле SxFy. Зная процентное содержание каждого элемента в соединении и его молярную массу, вычислим

3. Таким образом, простейшая формула соединения SF, а его молярная масса М = 32 + 19 = 51 г/моль. Так как соотношение истинной и простейшей молярных масс 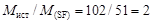 , то в искомой формуле содержится в 2 раза больше атомов каждого вида. Значит, формула соединения S2F2.
, то в искомой формуле содержится в 2 раза больше атомов каждого вида. Значит, формула соединения S2F2.
Пример 4. При окислении 2,81 г кадмия получено 3,21 г оксида кадмия. Вычислить эквивалентную массу кадмия и определить его валентность.
Решение. 1. По массе кадмия и массе его оксида найдем массу кислорода: m(O) = m(CdO) - m(Cd) = 3,21 - 2,81 = 0,4 г.
2. Образование оксида кадмия можно записать в виде схемы реакции Cd + O ® CdO, для которой составим пропорцию согласно закону эквивалентов:
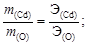
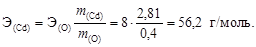
3. Сравнивая численные значения эквивалентной массы и молярной массы кадмия, найдем  . Следовательно, валентность кадмия 2.
. Следовательно, валентность кадмия 2.
Пример 5. Оксид марганца (IV) при прокаливании теряет кислород, образуя Mn3O4. Какой объем кислорода при температуре 27 °С и давлении 1,1 атм выделится из 0,58 кг MnO2
– Конец работы –
Эта тема принадлежит разделу:
Сборник задач Д.Э.Чиркст, Т.Е.Литвинова, О.В.Черемисина, Н.Я.Дубровская, И.И.Иванов, Л.В.Григорьева
На сайте allrefs.net читайте: "Сборник задач Д.Э.Чиркст, Т.Е.Литвинова, О.В.Черемисина, Н.Я.Дубровская, И.И.Иванов, Л.В.Григорьева"
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: ББК 24.1
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов