рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Сборник задач Д.Э.Чиркст, Т.Е.Литвинова, О.В.Черемисина, Н.Я.Дубровская, И.И.Иванов, Л.В.Григорьева
Реферат Курсовая Конспект
Сборник задач Д.Э.Чиркст, Т.Е.Литвинова, О.В.Черемисина, Н.Я.Дубровская, И.И.Иванов, Л.В.Григорьева
Сборник задач Д.Э.Чиркст, Т.Е.Литвинова, О.В.Черемисина, Н.Я.Дубровская, И.И.Иванов, Л.В.Григорьева - раздел Химия, Министерство Образования Российской Федерации Государственное Образо...
Министерство образования Российской Федерации
Государственное образовательное учреждение
высшего профессионального образования
Санкт-Петербургский государственный горный институт им. Г.В.Плеханова
(технический университет)
общая химия
Сборник задач
Д.Э.Чиркст, Т.Е.Литвинова, О.В.Черемисина, Н.Я.Дубровская, И.И.Иванов, Л.В.Григорьева
Приведены краткий теоретический материал, примеры решения задач и задания по основным разделам общей химии: основным законам, строению вещества,… Сборник задач предназначен для студентов всех специальностей, изучающих…ББК 24.1
1. Основные классы неорганических соединений. Номенклатура К основным классам неорганических соединений относятся оксиды, гидроксиды, кислоты, соли. Рассмотрим основы…Таблица 4.1
| Задача | Вещество | Концентрация раствора | Плотность раствора, г/см3 |
| H2SO4 | 15 % | 1,1 | |
| H3PO4 | 2,79 моль/л | 1,115 | |
| BaCl2 | 1,69 моль/л | 1,28 | |
| FeSO4 | 0,3 экв/л | 1,02 | |
| AlCl3 | 0,55 % | 1,007 | |
| CaCl2 | 22 % | 1,203 | |
| Na2CO3 | 0,39 моль/л | 1,019 | |
| HCl | 0,4 мол. % | 1,002 | |
| KOH | 3 мол. % | 1,073 | |
| NaOH | 13 % | 1,142 | |
| Al2(SO4)3 | 0,15 экв/л | 1,009 | |
| KMnO4 | 0,25 экв/л | 1,027 | |
| K2Cr2O7 | 0,18 моль/кг | 1,033 | |
| CrCl3 | 0,6 экв/л | 1,022 | |
| CdCl2 | 0,5 моль/л | 1,08 | |
| MnCl2 | 10 % | 1,086 | |
| Hg(NO3)2 | 0,25 моль/л | 1,174 | |
| ZnSO4 | 1,374 экв/л | 1,107 | |
| KOH | 34 % | 1,336 | |
| MgSO4 | 20 % | 1,219 | |
| H2SO4 | 1,56 моль/л | 1,095 | |
| H3PO4 | 7,3 мол. % | 1,181 | |
| NaBr | 5,8 мол. % | 1,21 | |
| NaCl | 7,1 мол. % | 1,147 | |
| HCl | 17,4 мол. % | 1,149 | |
| H2SO4 | 3,4 мол. % | 1,109 | |
| KOH | 6,3 мол. % | 1,147 | |
| H2SO4 | 5,9 мол. % | 1,18 | |
| KOH | 8,107 экв/л | 1,336 | |
| Pb(NO3)2 | 30 % | 1,328 | |
| H3PO4 | 30 % | 1,181 | |
| NaBr | 26 % | 1,21 | |
| NaCl | 15 % | 1,109 | |
| КОН | 560 г/л | 1,411 | |
| H3PO4 | 855 г/л | 1,426 |
Окончание табл.4.1
| Задача | Вещество | Концентрация раствора | Плотность раствора, г/см3 |
| H3PO4 | 3 мол. % | 1,08 | |
| HNO3 | 10,4 экв/л | 1,31 | |
| H2SO4 | 40 % | 1,303 | |
| ZnSO4 | 87 г/л | 1,084 | |
| H2SO4 | 30 % | 1,218 | |
| КОН | 0,12 моль/кг | 1,0 | |
| HNO3 | 10,4 н. | 1,31 | |
| NH4OH | 9 % | 0,961 | |
| NaCl | 4,5% | 1,03 | |
| CuSO4 | 1,037 моль/кг | 1,206 | |
| FeCl3 | 1,9 моль/л | 1,234 | |
| NH4OH | 10 % | 0,957 | |
| H2SO4 | 20 % | 1,139 | |
| H3PO4 | 24 % | 1,14 | |
| BaCl2 | 10 % | 1,092 |
Задание II.Решить задачи.
51. Какой объем 88-процентного раствора серной кислоты плотностью 1,8 г/см3 надо взять, чтобы приготовить 2 л этой же кислоты концентрацией 2,36 моль/л?
52. Какое количество миллилитров 12 н. раствора едкого кали (КОН) надо взять, чтобы приготовить 500 мл 15-процентного раствора едкого кали плотностью 1,14 г/см3?
53. Какое количество воды надо добавить к 200 мл 52-процентного раствора едкого натра плотностью 1,35 г/см3, чтобы получить раствор с концентрацией 2,78 моль/л?
54. Раствор серной кислоты концентрацией 3 моль/л имеет плотность 1,18 г/см3. Какое количество воды надо добавить к 118 г этого раствора, чтобы получить раствор с концентрацией 12 %?
55. Сколько воды надо добавить к 125 мл 26-процентного раствора соляной кислоты плотностью 1,13 г/см3, чтобы получить раствор с концентрацией 14,5 %?
56. Какое количество воды надо добавить к 150 г раствора хлорида бария в воде (концентрация 2 экв/л, плотность 1,2 г/см3), чтобы получить раствор с концентрацией 8 %?
57. Какое количество миллилитров раствора фосфорной кислоты, мольная доля которого 0,01 (плотность раствора 1,025 г/см3), надо взять, чтобы получить 200 г раствора с концентрацией 2,6 %?
58. Сколько миллилитров 2,25 М раствора хлорида калия надо взять, чтобы приготовить 1,5 л 6-процентного раствора плотностью 1,04 г/см3?
59. Какой объем раствора соляной кислоты (концентрация 38 %, плотность 1,189 г/см3) потребуется для приготовления 250 мл 0,08 н. раствора?
60. Сколько миллилитров раствора серной кислоты (концентрация 96 %, плотность 1,84 г/см3) потребуется для приготовления 2 л 0,25 н. раствора?
61. Сколько граммов едкого кали надо взять для приготовления 2 л раствора концентрацией 10 % и плотностью 1,09 г/см3?
62. Какой объем раствора серной кислоты (концентрация 98 %, плотность 1,837 г/см3) надо взять для приготовления 500 мл 0,1 н. раствора?
63. Какой объем 3 н. раствора фосфорной кислоты надо взять для приготовления 1 л 0,5 М раствора?
64. Как приготовить 500 мл 0,5 н. раствора соды из 2 н. ее раствора?
65. Сколько миллилитров воды надо прибавить к 300 мл раствора едкого кали, (концентрация 25 %, плотность 1,236 г/см3), чтобы получить 8-процентный раствор?
66. Какой объем азотной кислоты (концентрация 56 %, плотность 1,345 г/см3) потребуется для приготовления 1 л 0,1 М раствора?
67. Сколько миллилитров воды надо прибавить к 100 мл раствора серной кислоты (концентрация 48 %, плотность 1,376 г/см3), чтобы получить 0,5 н. раствор?
68. До какого объема надо разбавить 200 мл 1 н. раствора хлорида натрия, чтобы получить раствор концентрацией 4,5 % и плотностью 1,029 г/см3?
69. Сколько граммов сульфата натрия надо прибавить к 1 л раствора (концентрация 10 %, плотность 1,09 г/см3), чтобы получить 15-процентный раствор?
70. Сколько воды надо прибавить к 200 мл раствора азотной кислоты (концентрация 32 %, плотность 1,193 г/см3), чтобы получить 10-процентный раствор?
71. Сколько раствора соляной кислоты (концентрация 36 %, плотность 1,179 г/см3) потребуется для приготовления 1 л 0,5 н. раствора?
72. Сколько воды надо добавить к 50 мл 2 н. раствора, чтобы получить 0,25 н. раствор?
73. Сколько граммов хлорида аммония надо добавить к 5 л 2,1 М раствора плотностью 1,054 г/см3, чтобы получить 20-процентный раствор?
74. Сколько граммов едкого натра надо взять для приготовления 2 л раствора концентрацией 10 % и плотностью 1,080 г/см3?
75. Как приготовить 1 л 1 н. раствора KOH из 49-процентного раствора той же щелочи плотностью 1,5 г/см3?
76. Имеется раствор серной кислоты (концентрация 80 %, плотность 1,732 г/см3). Как из него приготовить 2 л 6 М раствора H2SO4?
77. Сколько серной кислоты (концентрация 60 %, плотность 1,503 г/см3) надо взять для приготовления 10 л 0,1 н. ее раствора?
78. Сколько воды надо испарить, чтобы из 10 л 0,25 М раствора ортофосфорной кислоты получить 6 М раствор?
79. В лаборатории имеется 20 кг 12-процентного раствора поташа K2CO3. Сколько килограммов технического поташа, содержащего 8 % посторонних примесей, надо взять для повышения концентрации имеющегося раствора до 20 %?
80. Какой объем раствора карбоната натрия (концентрация 10 %, плотность 1,105 г/см3) требуется для приготовления 5 л 2-процентного раствора плотностью 1,02 г/см3?
81. Сколько граммов хлористого аммония потребуется для приготовления 600 мл 0,5 М раствора?
82. Какую массу нитрата свинца (II) надо взять для приготовления 300 мл 0,2 н. раствора?
83. Сколько граммов медного купороса (пентагидрата сульфата меди (II)) надо взять для приготовления 1 л 2 н. раствора?
84. Какой процентной концентрации получится соляная кислота, если к 100 мл раствора HCl (концентрация 36 %, плотность 1,179 г/см3) прибавить 200 мл воды?
85. Сколько граммов азотной кислоты содержится в 1 л 36-процентного раствора плотностью 1,221 г/см3?
86. Какой процентной концентрации получится раствор, если к 500 мл 30-процентного раствора КОН плотностью 1,288 г/см3 прибавить 500 мл воды?
87. Какой объем аммиака следует растворить в воде при 25 °С и 120 кПа для получения 2 л 10-процентного раствора гидроксида аммония, плотностью 0,96 г/см3?
88. Какая масса сульфита натрия потребуется для приготовления 5 л 8-процентного раствора плотностью 1,075 г/см3?
89. Сколько воды надо прибавить к 50 мл 2 М раствора ортофосфорной кислоты, чтобы получить 0,25 н. раствор?
90. Какой объем воды потребуется для растворения 67,2 л хлороводорода, приведенного к нормальным условиям, для получения 9-процентного раствора плотностью 1,04 г/мл?
91. Сколько граммов десятиводного сульфата натрия нужно растворить в 800 мл воды для получения раствора с концентрацией по безводному сульфату натрия 10 %?
92. Какая масса хлорида калия потребуется для приготовления 200 мл раствора с концентрацией 1,455 моль/л?
93. Необходимо приготовить 100 г раствора хлорида бария с концентрацией 5 %. Какая масса дигидрата хлорида бария потребуется для этого?
94. Какой объем раствора серной кислоты (концентрация 30 %, плотность 1,12 г/см3) потребуется для приготовления 2 л раствора концентрацией 0,4 н.?
95. Какой объем аммиака при температуре 25 °С и давлении 1 атм следует растворить в 1 л воды для получения раствора гидроксида аммония концентрацией 20 %?
96. Рассчитать, какой объем воды следует взять для растворения 16 г СН3ОН для получения раствора метанола с мольной долей 0,02.
97. Раствор хлорида алюминия в воде имеет концентрацию 2 экв/л и плотность 1,08 г/см3. К 50 г этого раствора добавили 35 мл воды, и его плотность стала 1,035 г/см3. Найти массовую долю хлорида алюминия в новом растворе.
98. Сколько 5-процентного раствора можно приготовить из 1 т плавленого сульфида натрия, содержащего 30 % примесей?
99. Раствор хлорида алюминия в воде имеет концентрацию 2,18 экв/л и плотность 1,08 г/см3. К 50 г этого раствора добавили 35 мл воды и его плотность стала 1,044 г/см3. Найти концентрацию нового раствора в процентах.
100. К 200 мл 0,7 н. раствора серной кислоты прибавили 300 г воды. Рассчитать конечную концентрацию серной кислоты в граммах на литр.
101. Смешали 20 мл 0,5 н. раствора соляной кислоты и 10 мл 0,2 н. раствора гидроксида бария. Какое вещество и в каком количестве будет находиться в растворе в избытке?
102. Раствор хлорида бария содержит 2,3 г бария. Сколько миллилитров 0,5 н. раствора серной кислоты потребуется для осаждения всего бария в виде сульфата?
103. Сколько и какого вещества останется в избытке, если к 75 мл 0,3 н. раствора серной кислоты прибавить 125 мл 0,2 н. раствора калиевой щелочи?
104. Для осаждения в виде хлорида всего серебра, содержащегося в 100 мл раствора нитрата серебра, потребовалось 50 мл 0,2 н. раствора соляной кислоты. Какова нормальность раствора нитрата серебра, и какая масса хлорида серебра выпала в осадок?
105. На нейтрализацию 31 мл 0,16 н. раствора щелочи требуется 217 мл раствора серной кислоты. Чему равна нормальность раствора серной кислоты?
106. Какой объем 0,3 н. раствора кислоты требуется для нейтрализации раствора, содержащего 0,32 г гидроксида натрия в 40 мл?
107. На нейтрализацию 1 л раствора, содержащего 1,4 г гидроксида калия, требуется 50 мл раствора кислоты. Вычислить нормальность раствора кислоты.
108. Какая масса азотной кислоты содержалась в растворе, если на нейтрализацию его потребовалось 35 мл 0,4 н. раствора гидроксида натрия?
109. Сколько миллилитров 1 н. раствора едкого натра потребуется для полной нейтрализации 300 мл 0,1 М раствора серной кислоты?
110. Смешали 1 л раствора соляной кислоты (концентрация 20 %, плотность 1,098 г/см3) и 1 л раствора соляной кислоты (концентрация 12,5 %, плотность 1,06 г/см3). Какой молярной концентрации раствор получится после смешивания?
111. Сколько миллилитров 0,1 н. едкого натра (NaOH) потребуется для осаждения меди в виде гидроксида из 20 мл раствора сульфата меди, в 1 л которого содержится 10 г меди?
112. Сколько миллилитров соляной кислоты (концентрация 10 %, плотность 1,047 г/ см3) потребуется для нейтрализации раствора, содержащего 8,5 г гидроксида бария?
113. Сколько миллилитров раствора соды, содержащего в 1 л 21,2 г соли, надо добавить к 30 мл 0,2 н. раствора хлорида кальция для полного осаждения кальция в виде карбоната?
114. Сколько граммов гидроксида железа выпадет в осадок, если к 500 мл 0,2 н. раствора хлорида железа (III) добавить избыток щелочи?
115. В каком объемном отношении надо смешать растворы гидроксида бария с концентрацией 95,5 г/л и 0,5 н. соляной кислоты для получения раствора с нейтральной средой?
116. На нейтрализацию 20 мл раствора едкого кали потребовалось 13 мл 0,2 н. раствора кислоты. Сколько граммов едкого кали содержится в 1 л раствора?
117. Сколько миллилитров раствора нитрата серебра, содержащего 5 г/л серебра, надо добавить к 10 мл 0,2 н. раствора хлорида натрия, чтобы полностью удалить из раствора ионы хлора?
118. Сколько миллилитров 2 н. серной кислоты потребуется для превращения 1,56 г гидроксида алюминия в сульфат алюминия?
119. Сколько граммов карбоната кальция можно растворить в 100 мл соляной кислоты (концентрация 20 %, плотность 1,1 г/см3)? Вычислить объем, который займет выделившийся газ при нормальных условиях.
120. К 5 г цинка прибавили 100 мл 10,2-процентной соляной кислоты (плотность раствора 1,05 г/см3). Какое вещество и в каком количестве осталось в избытке? Вычислить объем водорода, выделившегося при 20 ºС и 750 мм рт. ст.
121. На нейтрализацию 20 мл раствора гидроксида калия (концентрация 5,66 %, плотность 1,053 г/см3) пошло 12,1 мл раствора серной кислоты плотностью 1,052 г/см3. Определить процентную концентрацию раствора серной кислоты.
122. Какое количество миллилитров 0,5 н. раствора сульфата натрия надо долить к 100 мл раствора хлорида бария (концентрация 16 %, плотность 1,156 г/см3), чтобы полностью осадить сульфат-ион?
123. На нейтрализацию 50 мл раствора фосфорной кислоты плотностью 1,01 г/см3 израсходовано 31,2 г 1 н. раствора гидроксида натрия плотностью 1,04 г/см3. Определить процентную концентрацию фосфорной кислоты.
124. 10 г сплава меди с цинком обработали соляной кислотой. При этом выделилось 570 мл водорода, измеренных при температуре 27 ºС и давлении 105 Па. Определить состав сплава и выразить его в массовых и мольных долях.
125. При растворении 15 г сплава серебра с алюминием раствором едкого натра выделилось 13 мл водорода, измеренного при температуре 57 ºС и давлении 15×105 Па. Определить состав сплава и выразить его в массовых и мольных долях.
126. При растворении в азотной кислоте 5 г сплава меди и золота выделилось 0,99 мл оксида азота (II), измеренных при температуре 37 ºС и давлении 1,2×105 Па. Определить состав сплава и выразить его в массовых и мольных долях.
127. Для нейтрализации 20 мл 0,1 н. раствора кислоты потребовалось 8 мл раствора гидроксида натрия. Сколько граммов NaOH содержит 1 л этого раствора?
128. Какой объем 0,2 н. раствора кислоты требуется для нейтрализации раствора, содержащего 0,51 г гидроксида калия в 30 мл?
129. Сколько и какого вещества останется в избытке, если к 150 мл 0,4 н. раствора соляной кислоты прибавить 250 мл 0,2 н. раствора гидроксида натрия?
130. Смешали 100 мл 1,5 н. раствора и 100 мл 0,5 н. раствора серной кислоты. Рассчитать молярность полученного раствора.
131. К 100 мл раствора едкого натра (концентрация 10 %, плотность 1,109 г/см3) прибавили 200 мл раствора NaOH (концентрация 20 %, плотность 1,219 г/см3). Рассчитать нормальность полученного раствора.
132. К 500 мл раствора хлорида натрия (концентрация 6 %, плотность 1,04 г/см3) прибавили 1 л раствора хлорида калия концентрацией 8 % и плотностью 1,05 г/см3. Рассчитать молярную концентрацию хлорид-иона в растворе после смешения.
133. Смешали два раствора нитрата натрия концентрацией 0,8 и 0,2 моль/л в пропорции 2:1. Рассчитать молярную концентрацию полученного раствора.
134. Определить эквивалентную массу кислоты, если на нейтрализацию раствора, содержащего 0,63 г кислоты, израсходовано 20 мл 0,5 н. раствора щелочи.
135. Смешали 2 л раствора сульфата меди (II) концентрацией 2 % и плотностью 1,02 г/см3 и 1 л раствора хлорида меди (II) концентрацией 0,1 н. Рассчитать молярную концентрацию меди в полученном растворе.
136. К 50 мл раствора NaCl концентрацией 10 г/л прибавили 100 мл раствора NaCl концентрацией 2 г/л. Рассчитать молярную концентрацию полученного раствора.
137. К 100 л раствора соли железа с содержанием по железу 5 г/л прибавили 50 л раствора нитрата железа (III) концентрацией 0,3 моль/л. Рассчитать молярную концентрацию железа в полученном растворе.
138. На нейтрализацию раствора, содержащего 4,05 г кислоты, израсходовано 40 мл раствора едкого натра (NaOH) концентрацией 10 % и плотностью 1,109 г/см3. Определить эквивалентную массу кислоты.
139. К 50 л раствора фосфорной кислоты концентрацией 8 % и плотностью 1,042 г/см3 прибавили 2 л фосфата натрия концентрацией 5 г/л. Рассчитать молярную концентрацию фосфат-иона в полученном растворе.
140. Смешали 54 мл раствора NaOH концентрацией 0,5 % и плотностью 1 г/см3 и 10 мл 2-процентного раствора NaOH плотностью 1,02 г/см3. Рассчитать концентрацию полученного раствора (в процентах).
141. Смешали 120 л раствора с содержанием никеля 0,8 моль/л, 500 л раствора с содержанием никеля 1 г/л и 50 л раствора (концентрация NiSO4 14 %, плотность 1,158 г/см3). Рассчитать молярную концентрацию никеля в полученном растворе.
142. На нейтрализацию 10 мл раствора серной кислоты концентрацией 22 % и плотностью 1,155 г/см3 потребовалось 50 мл раствора щелочи концентрацией 41,6 г/л. Определить эквивалентную массу щелочи.
143. Смешали 4 мл серной кислоты (концентрация 40 %, плотность 1,303 г/см3) и 200 мл серной кислоты концентрацией 0,001 моль/л. Рассчитать нормальную концентрацию полученного раствора.
144. Смешали 8 л раствора соляной кислоты концентрацией 4 моль/л и 11 л раствора той же кислоты концентрацией 2 г/л. Рассчитать концентрацию полученного раствора в граммах на литр.
145. Сколько известняка с содержанием карбоната кальция 70 % потребуется для полной нейтрализации 10 л серной кислоты концентрацией 5 г/л?
146. Смешали 7 л раствора магния концентрацией 0,1 моль/л и 5 л раствора соли кальция концентрацией по кальцию 4 г/л. Рассчитать общее содержание металлов в растворе (в молях на литр).
147. К раствору, содержащему 5 г сульфата цинка, объемом 2 л добавили 3 л раствора сульфата меди (II) концентрацией 0,3 моль/л. Рассчитать молярную концентрацию сульфат-иона в полученном растворе.
148. Смешали растворы нитрата аммония концентрацией 0,3 моль/кг и 0,08 моль/л в соотношении 1:3. Рассчитать моляльную концентрацию полученного раствора. Плотность всех растворов принять равной 1 г/см3.
149. К раствору объемом 30 мл, содержащему 10 г серной кислоты в 100 мл раствора, прибавили 40 мл раствора NaOH, содержащего 9 г гидроксида натрия в 100 мл раствора. Найти молярную концентрацию вещества, которое останется в избытке.
150. Смешали раствор нитрата серебра (концентрация 1 %, плотность 1,01 г/см3) и раствор соляной кислоты (концентрация 5 %, плотность 1,02 г/см3) в соотношении 3:4. Рассчитать молярную концентрацию нитрат-иона в полученном растворе.
151. Какой объем раствора серной кислоты (концентрация 10 %, плотность 1,07 г/см3) потребуется для полной нейтрализации 0,5 л раствора NaOH концентрацией 16 г/л?
152. Смешали 10 мл раствора HCl (концентрация 10 %, плотность 1,047 г/см3) и 10 мл раствора HCl (концентрация 6 %, плотность 1,028 г/см3). Рассчитать массовую долю и молярную концентрацию соляной кислоты в полученном растворе.
153. Из раствора нитрата серебра (концентрация 2 %, плотность 1,015 г/см3) по реакции с хлоридом натрия образуется 14,35 г хлорида серебра. Вычислить исходный объем раствора нитрата серебра.
154. Смешали 1 л 1 М раствора CuSO4 и 2 л 0,5 М раствора CuSO4. Рассчитать содержание меди в полученном растворе в граммах на литр.
155. Сколько миллилитров 0,5 н. раствора сульфата натрия нужно добавить к 100 мл раствора хлорида бария (концентрация 16 %, плотность 1,156 г/см3), чтобы полностью осадить сульфат-ионы?
156. Металл вытеснил из 100 мл соляной кислоты 348 мл водорода, измеренного при 20 °С и 99,5 кПа. Рассчитать нормальную концентрацию хлорида металла в полученном растворе.
4.2. Коллигативные свойства растворов
Свойства растворов (температура замерзания и кипения, давление насыщенного пара, осмотическое давление) зависят от природы растворителя и концентрации раствора и называются коллигативными свойствами, так как не зависят от природы растворенного вещества.
Закон Рауля.Закон формулируется следующим образом: относительное понижение давления насыщенного пара растворителя над раствором равно молярной доле растворенного вещества в растворе. Согласно закону, понижение парциального равновесного давления насыщенного пара растворителя над раствором является линейной функцией мольной доли растворенного вещества в растворе:
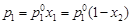 (4.7)
(4.7)
или
 (при n2 << n1), (4.8)
(при n2 << n1), (4.8)
где 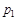 - давление насыщенного пара растворителя над раствором;
- давление насыщенного пара растворителя над раствором;  - давление насыщенного пара над индивидуальным растворителем; х1 и х2 – мольные доли растворителя и растворенного вещества в растворе.
- давление насыщенного пара над индивидуальным растворителем; х1 и х2 – мольные доли растворителя и растворенного вещества в растворе.
Изменение температур фазовых переходов растворов. Повышение температуры кипения
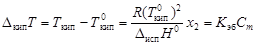 , (4.9)
, (4.9)
где 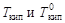 - соответственно температуры кипения раствора и индивидуального растворителя; Сm – моляльная концентрация растворенного вещества, моль/кг; Kэб – эбуллиоскопическая константа растворителя,
- соответственно температуры кипения раствора и индивидуального растворителя; Сm – моляльная концентрация растворенного вещества, моль/кг; Kэб – эбуллиоскопическая константа растворителя,  .
.
Изменение температуры кристаллизации
 , (4.10)
, (4.10)
где 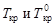 - соответственно температуры кристаллизации раствора и чистого растворителя; Сm – моляльная концентрация растворенного вещества; Kкр – криоскопическая постоянная растворителя,
- соответственно температуры кристаллизации раствора и чистого растворителя; Сm – моляльная концентрация растворенного вещества; Kкр – криоскопическая постоянная растворителя, 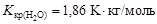 .
.
Осмотическое давление. Процесс самопроизвольного перехода растворителя в раствор через полупроницаемую мембрану называется осмосом. Давление, которое нужно приложить к раствору, чтобы осмос прекратился, называется осмотическим давлением, которое можно вычислить по формуле
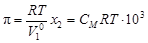 , (4.11)
, (4.11)
где  – объем 1 моль растворителя, м3.
– объем 1 моль растворителя, м3.
Для электролитов необходим поправочный множитель i, названный изотоническим коэффициентом:
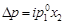 ; (4.12)
; (4.12)
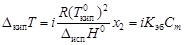 ;
;
 ;
;
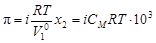 .
.
Изотонический коэффициент – показатель увеличения (уменьшения) числа частиц вследствие диссоциации (ассоциации). При i > 1 протекает процесс диссоциации, при i < 1 – процесс ассоциации. Численное значение изотонического коэффициента позволяет вычислить степень диссоциации и ассоциации. Соответственно
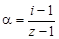 ;
;  ,
,
где z – число частиц, получающихся из одной частицы при диссоциации; z¢ – число частиц, объединяющихся в одну при ассоциации.
Пример 6. относительное понижение упругости пара над раствором тростникового сахара (С12Н22О11) в воде составляет 2 %. Определить осмотическое давление этого раствора при температуре 47 ºС. Плотность раствора 1,15 г/см3. Определить изменение температуры плавления и кристаллизации, если Kэб = 0,52 K·кг/моль, Kкр = = 1,86 K·кг/моль, 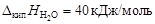 ;
;  ;
;  .
.
Решение. Из закона Рауля (4.7), (4.8) следует, что мольная доля сахара в растворе составляет 0,02. По формуле (4.9) определим повышение температуры кипения раствора:
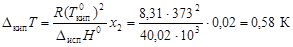 .
.
По формуле (4.10) понижение температуры замерзания раствора:
 .
.
вычислим осмотическое давление по формуле (4.11):  .
.
Пример 7. Раствор магния в олове содержит 0,833 г магния в 100 г олова. Температура плавления олова 505 К, а теплота плавления 7200 Дж/моль. Определить температуру начала кристаллизации этого раствора.
Решение. определим мольную долю х2 магния в олове:
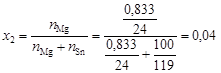 .
.
по уравнению (4.10) вычислим температуру кристаллизации расплава:
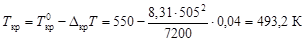
Пример 8. В системе свинец (II)-серебро (I) при Т = 1490 К закон Рауля справедлив для растворов, содержащих менее 18 % свинца. Давление насыщенного пара над чистым серебром 7,47 Па. Вычислить давление пара серебра над раствором, содержащим 17,5 % свинца.
Решение. выделим мысленно 100 г расплава и примем их за 100 %, тогда 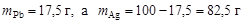 . мольная доля свинца в сплаве
. мольная доля свинца в сплаве
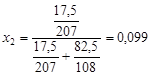 .
.
По уравнению (4.8) вычислим давление пара серебра над расплавом
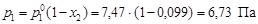 .
.
Пример 9. Давление насыщенного пара над раствором, содержащим 5 г едкого натра в 180 г воды, при 100 ºС составляет 0,99·105 Па. Давление насыщенного пара над чистой водой при 100 ºС составляет 1,01·105 Па. Определить состояние едкого натра в растворе.
Решение. Состояние едкого натра в растворе можно оценить по величине изотонического коэффициента i. По закону Рауля (4.8)


Из уравнения (4.12) вычислим

полученное значение i > 1 указывает на наличие диссоциации NaOH. Кажущаяся степень диссоциации
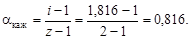
Задание III. Решить задачи.
157. Определить осмотическое давление раствора, содержащего 30 г глицерина в 120 г воды, если плотность этого раствора близка к единице, а температура 27 °С.
158. Определить осмотическое давление раствора хлорида натрия в воде концентрацией 5 %, если плотность раствора 1,04 г/см3, температура 17 °С. Кажущаяся степень диссоциации 95 %.
159. К 100 мл 0,5 М водного раствора сахарозы С12Н22О11 добавлено 300 мл воды. Чему равно осмотическое давление полученного раствора при 25 °С?
160. При 293 K давление насыщенного пара над водой равно 2,34 кПа. Сколько граммов глицерина С3Н5(ОН)3 надо растворить в 180 г воды, чтобы понизить давление пара на 133,3 Па?
161. При растворении 13 г неэлектролита в 400 г диэтилового эфира (С2Н5)2О температура кипения раствора повысилась на 0,453 K. Определить молярную массу растворенного вещества.
162. В 60 г бензола растворено 2,09 г некоторого вещества, содержащего 50,69 % С, 4,23 % Н, 45,08 % О. Установить молекулярную формулу вещества. Чистый бензол кристаллизуется при 5,5 °С.
163. Температура кипения водного раствора сахарозы С12Н22О11 101,4°С. Вычислить молярную концентрацию и массовую долю сахарозы в растворе. При какой температуре этот раствор замерзает?
164. Определить осмотическое давление раствора хлорида бария в воде, если его концентрация 5 %, плотность 1,08 г/см3, температура 7 °С, кажущаяся степень диссоциации 97 %.
165. Определить кажущуюся степень диссоциации хлорида калия в его 0,1 н. водном растворе, если при температуре 27 °С осмотическое давление раствора 4,72×105 Па.
166. Осмотическое давление гипертонического раствора (водный раствор хлорида натрия концентрацией 10 %) при температуре 20 °С составляет 84×105 Па. Найти кажущуюся степень диссоциации соли в этом растворе, если его плотность 1,1 г/см3.
167. Установить концентрацию раствора сульфата натрия в воде и выразить ее всеми способами, если известно, что осмотическое давление раствора при температуре 15 °С составляет 32,5×105 Па, кажущаяся степень диссоциации 91 %.
168. Водный раствор соли хрома (III) имеет осмотическое давление 18,1×105 Па, плотность раствора 1,06 г/см3. Определить концентрацию раствора и выразить ее всеми способами, если соль диссоциирована нацело.
169. Сколько граммов хлорида кальция надо растворить в 1 л воды, чтобы полученный раствор при температуре 27 °С имел осмотическое давление 23,7×105 Па? Кажущаяся степень диссоциации 95 %.
170. Сколько граммов сульфата меди (II) надо растворить в 100 мл воды, чтобы при температуре 7 °С полученный раствор имел осмотическое давление 16×105 Па? Кажущаяся степень диссоциации 87 %.
171. Определить концентрацию хлорид-ионов в растворе хлорида ртути (II), если при температуре 17 °С и концентрации раствора 0,1 моль/л его осмотическое давление 2,62×105 Па.
172. Раствор роданида железа (III) в воде с концентрацией 0,5 моль/л при температуре 27 °С имеет осмотическое давление 15,5×105 Па. Определить концентрацию роданид-ионов в данном растворе.
173. Найти давление паров воды над раствором хлорида натрия концентрацией 5 %, если температура раствора 20 °С, кажущаяся степень диссоциации 98 %, 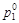 =2,3×105 Па.
=2,3×105 Па.
174. Определить молярную концентрацию раствора карбамида, если при температуре 35 °С давление паров воды над раствором оказалось на 2 % ниже, чем над индивидуальной водой (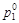 =5,55×105 Па). Карбамид в водных растворах не диссоциирует.
=5,55×105 Па). Карбамид в водных растворах не диссоциирует.
175. Вычислить кажущуюся степень диссоциации сульфата калия в его водном растворе концентрацией 3 %, если относительное понижение давления паров воды над раствором составляет 9,23×10-3Па.
176. Рассчитать давление паров воды над 0,5-процентным раствором хлорида бария при 15 °С, если кажущаяся степень диссоциации 96 %, 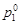 = 1,683×105 Па.
= 1,683×105 Па.
177. Определить концентрацию сульфата цинка в водном растворе, если относительное понижение давления пара над этим раствором 0,1 %, и соль диссоциирована нацело.
178. Какова концентрация хлорида алюминия в растворе, если относительное понижение давления пара над раствором 0,16 %, степень диссоциации соли 100 %?
179. Осмотическое давление раствора хлорида натрия при температуре 20 °С составляет 8,4×105 па. Определить давление паров воды над этим раствором, если плотность раствора 1,05 г/см3, кажущаяся степень диссоциации соли 92 %, 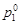 =2,31×103 Па.
=2,31×103 Па.
180. Раствор хлорида калия в воде имеет осмотическое давление 9,44×105 Па. Определить давление паров воды над этим раствором, если его температура 27 °С, плотность раствора 1,07 г/см3, кажущаяся степень диссоциации соли 92 %, 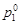 =3,5×105Па.
=3,5×105Па.
181. Определить давление паров воды над раствором глицерина С3Н5(ОН)3, если в 100 г воды растворено 20 г глицерина, плотность раствора 1,1 г/см3, 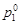 =1,95×105 Па.
=1,95×105 Па.
182. Определить концентрацию раствора сульфата натрия в воде, если при температуре 22 °С давление паров воды над этим раствором 2,61×103 Па, кажущаяся степень диссоциации 95,7 %, 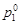 =2,62×103 Па.
=2,62×103 Па.
183. При какой температуре закипит водный раствор хлорида меди (II) концентрацией 2 %, если кажущаяся степень диссоциации 97 %?
184. Найти температуру кипения раствора сульфата натрия в воде, если при 27 °С раствор этой соли имеет осмотическое давление 7,16×105 Па, плотность 1,06 г/см3. Кажущаяся степень диссоциации 96 %.
185. Какой должна быть концентрация раствора хлорида цинка в воде, чтобы этот раствор закипал при температуре 100,52 °С? Соль диссоциирована на 100 %. Выразить концентрацию раствора (плотность 1,04 г/см3) всеми способами.
186. Определить кажущуюся степень диссоциации нитрата натрия, если этот раствор кипит при температуре 100,1 °С, а в 100 г воды растворено 0,85 г соли.
187. Раствор хлорида алюминия в воде концентрацией 0,2 моль/кг кипит при температуре 100,406 °С. Найти осмотическое давление этого раствора при температуре кипения, если его плотность 1,06 г/см3.
188. В 100 г воды содержится 0,58 г хлорида натрия. При какой температуре закипит этот раствор, если кажущаяся степень диссоциации 96 %?
189. Какова кажущаяся степень диссоциации бромида калия в растворе концентрацией 2 %, если он закипает при 100,17 °С.
190. Определить эбуллиоскопическую постоянную этилового спирта, если известно, что раствор, содержащий 0,506 г йодноватой кислоты и 31,8 г этанола, кипит при температуре 78,464 °С. В данных условиях кислота диссоциирована на 32,6 %, а температура кипения чистого этанола 78,3 °С.
191. Вычислить относительное понижение давления водяного пара над раствором хлорида кобальта (II), если при кажущейся степени диссоциации 93 % раствор кипит при температуре 100,30 °С.
192. Определить, сколько граммов глицерина надо добавить к 100 г воды, чтобы получившийся раствор не замерзал до температуры –3,2 °С.
193. При какой температуре начнется кристаллизация воды из раствора хлорида калия концентрацией 3 %, если кажущаяся степень диссоциации 89 %?
194. Определить кажущуюся степень диссоциации сульфата магния в его 0,1 н. растворе плотностью 1,02 г/см3, если этот раствор начинает кристаллизоваться при температуре –0,153 °С.
195. При какой температуре начнет кристаллизоваться раствор сульфата железа (II) концентрацией 2 %, если его температура кипения 100,136 °С?
196. При какой температуре закипит раствор глицерина в воде, если он кристаллизуется при температуре –1,5 °С?
197. Кажущаяся степень диссоциации некоторой соли, диссоциирующей на три иона, составляет 97 %. Определить, при какой температуре начнет кристаллизоваться раствор этой соли в воде, если он закипает при температуре 100,2 °С.
198. Относительное понижение давления паров воды над раствором сульфата калия концентрацией 3 % составляет 9,23×10-3. Определить, при какой температуре начнется кристаллизация воды из этого раствора.
199. Раствор хлорида калия в воде концентрацией 0,8 % и плотностью 1,02 г/см3 при температуре 27 °С имеет осмотическое давление 5,13×105 Па. Определить, при какой температуре начнется кристаллизация этого раствора.
200. Температура кристаллизации бензола +5,5 °С, а раствора, содержащего 0,2242 г камфары в 30,55 г бензола, +5,254 °С. Определить молярную массу камфары, если константа кристаллизации бензола 5,16 K×кг/моль.
201. Раствор некоторого органического вещества в этиловом спирте закипает при температуре 78,41 °С. Определить его молярную массу, если для приготовления раствора было взято 2 г этого вещества, 48 г этилового спирта, температура кипения которого 78,3 °С, Kэб = 1,19 К×кг/моль.
202. Сколько граммов хлористого натрия надо добавить к 100 г воды, чтобы получившийся раствор не замерзал до температуры –1,8 °С? Считать, что соль диссоциировала на 100 %.
203. Сколько сахара С12Н22О11 надо растворить в 200 г воды, чтобы полученный раствор кипел при температуре 100,3 °С?
204. Сколько граммов хлорида бария, диссоциирующего нацело, надо растворить в 1 л воды, чтобы получившийся раствор замерзал при температуре –3,2 °С?
205. Осмотическое давление раствора глицерина в воде при температуре 7 °С составляет 5,3×105 Па. Определить при какой температуре закипит этот раствор, если его плотность 1,02 г/см3.
206. Определить степень диссоциации бензойной кислоты С6Н5СООН, если раствор ее в бензоле кристаллизуется при температуре 5,32 °С. Температура кристаллизации индивидуального бензола 5,5 °С, Kкр = 5,16 К×кг/моль, а для приготовления раствора взято 62,5 г бензола и 0,26 г бензойной кислоты.
207. Определить молярную массу бензойной кислоты, если известно, что ее раствор в бензоле кристаллизуется при температуре 5,18 °С. Для бензола Ткрист = 5,5 °С, Kкр = 5,16 К×кг×моль, а для приготовления раствора взято 100 г бензола и 0,757 г бензойной кислоты. Считать, что в растворе кислота практически не диссоциирована.
208. При какой температуре закипит раствор иодида калия в воде, если для его приготовления взято 300 мл воды и 1,33 г соли, кажущаяся степень диссоциации 98 %?
209. Относительное понижение давления паров воды над раствором некоторой соли составляет 1 %. Определить, при какой температуре закипит этот раствор.
210. Относительное понижение давления паров над раствором некоторого сильного электролита в воде составляет 1,5 %. Определить, при какой температуре начнется кристаллизация этого раствора.
211. Раствор, в 100 мл которого находится 2,3 г вещества, обладает при 298 К осмотическим давлением, равным 618,5 кПа. Определить молярную массу вещества.
212. В 1 мл раствора содержится 1018 молекул растворенного неэлектролита. Вычислить осмотическое давление раствора при 298 К.
213. В каком отношении должны находиться массы воды и этилового спирта, чтобы при их смешении получить раствор, замерзающий при -20 °С?
214. При 25 °С осмотическое давление некоторого водного раствора 1,24 МПа. Вычислить осмотическое давление раствора при 0 °С.
4.3. Водородный показатель
Для характеристики кислотно-основных свойств растворов используют водородный показатель рН, равный отрицательному значению десятичного логарифма концентрации ионов водорода. Аналогично рассчитывают гидроксильный показатель рОН, равный отрицательному значению десятичного логарифма концентрации ионов гидроксила:
 . (4.13)
. (4.13)
Концентрации ионов водорода и гидроксила связаны между собой равновесием диссоциации воды:
Н2О Û Н+ + ОН-.
Константу равновесия называют ионным произведением воды. При 298 К константа равновесия
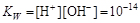 .
.
Прологарифмировав это уравнение, получим
рН + рОН = 14.
В чистой воде (нейтральная среда) рН = рОН = 7. В кислой среде рН < 7, в щелочной среде рН > 7.
Расчет рН в растворах сильных кислот и оснований. Для сильных кислот и щелочей, полностью диссоциированных на ионы,
[Н+] = zCк и [ОН-] = zCщ,
где Ск и Сщ - моляльные концентрации кислоты и щелочи соответственно; z - основность кислоты или кислотность основания.
Разбавление раствора сильного электролита учитывают в кислой и щелочной среде соответственно по уравнениям
рН2 = рН1 + lgn,
рН2 = рН1 – lgn,
где индекс 1 относится к исходному раствору (до разбавления), индекс 2 – к конечному раствору (после разбавления).
В среде, близкой к нейтральной, необходимо принять во внимание диссоциацию воды, в результате которой образуются ионы Н+иОН-.
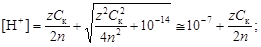 (4.14)
(4.14)
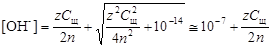 .
.
При смешивании растворов сильных кислот и оснований возможны два варианта:
· если смешивают два кислых или два щелочных раствора, т.е. рН1 < 7 и рН2 < 7 или рН2 > 7ирН2 > 7, то
 ; (4.15)
; (4.15)
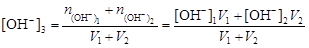 .
.
· если смешивают кислый и щелочной растворы, т.е. рН1 < 7 и рН2 > 7, то конечную концентрацию раствора рассчитывают по веществу, взятому в избытке. При избытке кислоты
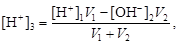
при избытке щелочи
 .
.
Расчет рН в растворах слабых кислот и оснований. Диссоциация многих электролитов протекает не полностью. Отношение числа диссоциированных молей к общему числу молей электролита в растворе называют степенью диссоциации. Для его количественного описания используют константу равновесия, называемую константой диссоциации. Для одноосновной кислоты, диссоциирующей по уравнению, НАn Û Н+ + Аn-, где Аn – кислотный остаток, константа диссоциации
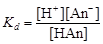 . (4.16)
. (4.16)
Так как [An–] = [H+] и [НAn] = C, то
 ;
;
(4.17)
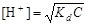 ,
,
где С – концентрация слабой кислоты, моль/л.
Для растворов слабых оснований
 , (4.18)
, (4.18)
где С – концентрация слабого основания, моль/л.
По значению константы диссоциации можно рассчитать степень диссоциации слабого электролита:
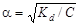 .
.
Многоосновные кислоты диссоциируют ступенчато, например: Н2S Û НS- + Н+(1-я ступень); НS- Û S2- + Н+ (2-я ступень).
При расчетах рН обычно учитывают только первую ступень диссоциации, пренебрегая второй и третьей ступенями. Таким образом, уравнения (4.16) и (4.18) справедливы и для многоосновных кислот при использовании первой константы диссоциации Kd1.
Константы диссоциации некоторых слабых кислот и оснований даны в прил.1.
Пример 10. Вычислить рН раствора серной кислоты концентрацией 0,3 % (d = 1,0 г/см3).
Решение. 1. Перейдем к моляльной концентрации серной кислоты. Для этого выделим мысленно 100 г раствора, тогда масса серной кислоты составит 0,3 г, а масса воды – 99,7 г. По уравнению (4.4) вычислим моляльную концентрацию:

2. Согласно уравнению диссоциации H2SO4 ® 2H+ + SO42-, из 1 моль серной кислоты образуется 2 моль H+, следовательно, 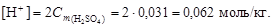
3. По уравнению (4.13) вычислим рН = –lg[H+] = –lg0,062 = = 1,21.
Пример 11. Вычислить рН раствора гидроксида бария концентрацией 0,0068 экв/л.
Решение. 1. По уравнению диссоциации Ba(OH)2 ® Ba2+ + + 2 OH- из 1 моль гидроксида бария образуется 2 моль гидроксил-ионов:

2. По уравнению (4.13) найдем рOН = –lg[OH-] = –lg0,0068 = = 2,17 и вычислим рН = 14 - рОН = 14 – 2,17 = 11,83.
Пример 12. Определить рН, если раствор одноосновной кислоты с рН = 5,5 разбавлен в 100 раз.
Решение. По уравнению (4.14) найдем концентрацию ионов водорода в конечном растворе
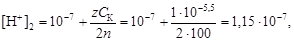
и вычислим
рН2 = –lg[H+]2 = –lg1,15×10-7 = 6,9.
Пример 13. Определить значение рН при смешении 10 л раствора с рН1 = 2 и 17 л раствора с рН2 = 4.
Решение. По уравнению (4.15) найдем концентрацию ионов водорода в конечном растворе
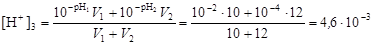
и вычислим рН3 = –lg[H+]3 = –lg(4,6×10-3) = 2,33.
Пример 14. Смешали 250 мл раствора с рН = 3 и 300 мл раствора гидроксида калия концентрацией 0,001 моль/л. Определить рН полученной смеси.
Решение. Обозначим объемы смешиваемых растворов V1 и V2 соответственно. Найдем число молей OH-:

Согласно уравнению диссоциации KOH ® K+ + OH-, 
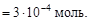
Найдем число молей H+:
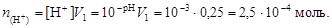
Очевидно, что в избытке находятся гидроксил-ионы. Их остаточную концентрацию в полученном растворе найдем по уравнению

Вычислим
рН3 = 14 + lg[OH-]3 = 14 + lg(9,1×10-5) = 9,96.
Пример 15. Найти рН раствора борной кислоты с мольной долей 0,0025 (dр-р = 1,0 г/см3).
Решение. 1. выделим мысленно 1 кг раствора. Запишем
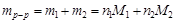 ,
,
где индекс 1 относится к растворителю, т.е. к воде, а индекс 2 – к растворенному веществу, т.е. к H3BO3. Так как M1 = 18 г/моль, М2 = 61,8 г/моль и
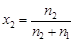 Þ
Þ 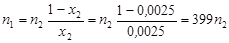 ,
,
то
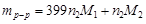 .
.
Вычислим
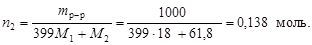
2. Так как плотность раствора 1 г/см3, то его объем соответствует 1 л, и молярная концентрация численно равна количеству вещества борной кислоты, т.е. СМ(Н3ВО3) = 0,138 моль/л.
3. Диссоциация борной кислоты по первой ступени протекает по реакции H3BO3 ® H+ + H2BO3-, для которой константа диссоциации Kd1 = 7,1×10-10. Второй и третьей ступенями диссоциации борной кислоты пренебрегаем.
4. В соответствии с уравнениями (4.17) и (4.13) вычислим
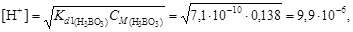
рН = –lg[H+] = –lg(9,9×10-6) = 5.
Пример 16. Сколько граммов бутиламина содержится в 1 л его раствора, имеющего рН = 11,5?
Решение. Гидрат бутиламина диссоциирует как основание по уравнению C4H9NH2×H2O Û C4H9NH3+ + OH-. Константа диссоциации Kd=4,57×10-4, pKd = 3,340, гидроксильный показатель рОН = 14 – рН = 2,5.
По формуле (4.18) найдем молярную концентрацию бутиламина
lgCМ = pKd – 2pOH = 3,34 – 2×2,5 = –1,66;
CМ = 10-1,66 = 0,022 моль/л.
Масса бутиламина, содержащаяся в 1 л раствора, Сг/л = CМM, где М – молярная масса бутиламина 73 г/моль. Тогда Сг/л =0,022×73 = 1,6 г/л.
Задание IV. Определить pH предложенного раствора сильного электролита (табл.4.2).
Таблица 4.2
| Номер задачи | Электролит | Концентрация раствора | Плотность раствора, г/см3 |
| Сa(OH)2 | 0,07 % | 1,00 | |
| Ba(OH)2 | 0,5 % | 1,003 | |
| H2SO4 | 0,01 мол. % | 1,0 | |
| Sr(OH)2 | 5×10-4 н. | 1,0 | |
| HCl | 1,36 % | 1,005 | |
| H2SO4 | 1,73 % | 1,012 | |
| KOH | 0,577 % | 1,003 | |
| H2SO4 | 5×10-4 М | 1,0 | |
| KOH | 0,001 н. | 1,0 | |
| HClO4 | 0,25 М | 1,013 | |
| NaOH | 2,5×10-3 М | 1,0 | |
| HCl | 1,0 % | 1,003 | |
| HNO3 | 3 % | 1,01 | |
| Ba(OH)2 | 5 % | 1,04 | |
| HCl | 0,3 % | 1,0 | |
| KOH | 5,8 г/л | 1,004 | |
| H2SO4 | 0,05 г/л | 1,0 | |
| KOH | 0,6 г/л | 1,0 | |
| Ba(OH)2 | 0,1 М | 1,02 | |
| H2SO4 | 0,1 н. | 1,0 | |
| H2SO4 | 0,5 % | 1,0 | |
| NaOH | 0,5 % | 1,0 | |
| HCl | 0,01 н. | 1,0 | |
| Сa(OH)2 | 0,02 н. | 1,0 | |
| KOH | 4 г/л | 1,0 | |
| NaOH | 5 г/л | 1,0 | |
| H2SO4 | 0,005 М | 1,0 | |
| HCl | 0,006 М | 1,0 | |
| LiOH | 0,8 г/л | 1,0 | |
| NaOH | 0,1 г/л | 1,0 | |
| RbOH | 1 % | 1,0 | |
| CsOH | 0,5 % | 1,0 | |
| HCl | 0,02 мол. % | 1,0 | |
| H2SO4 | 0,6 % | 1,003 | |
| HNO3 | 0,7 мол. % | 1,0 | |
| HClO4 | 0,08 мол. % | 1,0 | |
| H2SO4 | 0,3 % | 1,001 | |
| Окончание табл.4.2 | |||
| Номер задачи | Электролит | Концентрация раствора | Плотность раствора, г/см3 |
| HNO3 | 0,05 г/л | 1,0 | |
| HNO3 | 0,6 г/л | 1,0 | |
| H2SO4 | 0,03 н. | 1,0 | |
| Сa(OH)2 | 0,03 % | 1,00 | |
| Sr(OH)2 | 0,3 % | 1,001 | |
| Ba(OH)2 | 0,05 г/л | 1,0 | |
| HCl | 0,2 % | 1,0 | |
| H2SO4 | 0,0012 М | 1,0 | |
| HNO3 | 0,06 г/л | 1,0 | |
| Ba(OH)2 | 0,1 г/л | 1,0 | |
| Sr(OH)2 | 0,02 н. | 1,0 | |
| Сa(OH)2 | 0,09 г/л | 1,0 | |
| CsOH | 0,5 % | 1,002 |
Задание V. Определить pH следующих растворов.
265. Раствор гидроксида бария концентрацией 0,1 моль/л, если к 1 л этого раствора добавили 7,1 г гидроксида натрия.
266. Раствор серной кислоты концентрацией 0,1 моль/л, если к 1 л этого раствора добавили 7,1 г гидроксида бария.
267. Раствор после выщелачивания боксита по следующим данным: масса руды 1 т; ω(Al2O3∙Н2O) = 80 %; V(NaOH) = 3,1 м3; ω(NaOH) = 15 %.
268. 10-процентный раствор соляной кислоты (d = 1,047 г/мл) при условии, что к 20 л этого раствора прибавили 5 м3 воды, содержащей гидроксид кальция концентрацией 0,02 экв/л.
269. Раствор, содержащий 4 г KOH и 5 г NaOH в 1 л воды.
270. Раствор, содержащий 0,005 моль/л серной кислоты и 0,006 моль/л соляной кислоты.
271. Раствор после выщелачивания по реакции Li2O∙Al2O3∙4SiO2 + H2SO4 → Li2SO4 + Al2O3∙4SiO2∙H2O↓, если масса руды 1 т, w(Li2O∙Al2O3∙4SiO2) = 70 %; V(H2SO4) = 4 м3; w(H2SO4) = = 5 %, d = 1,032 г/мл.
272. Раствор после выщелачивания руды, если масса руды 1 т, в руде содержится 6 % Cu4(SO4)(OH)6; w(H2SO4) = 3 %, d = 1,03 г/мл, V(H2SO4) = 3 м3.
273. Раствор, полученный при разбавлении 20 л 10 % соляной кислоты (d = 1,047 г/мл) пятью кубометрами воды.
274. Рассчитать рН раствора азотнокислых стоков, если 10 л 5-процентной азотной кислоты сброшены в резервуар емкостью 5 м3.
275. Раствор соляной кислоты, если к 100 мл этого раствора, содержащего 5 мг HCl, прибавили 5 мг нитрата свинца (II).
276. Раствор объемом 10 м3, содержащий по 50 г серной и дихромовой кислот.
277. Щелочные стоки объемом 5 л, содержащие 2 мэкв щелочи.
278. Раствор дихромовой кислоты, если в нем содержится 2 мг/мл Cr (VI).
Задание VI. Определить pH и степень диссоциации предложенного раствора слабого электролита при температуре 25 °С (табл.4.3.)
Таблица 4.3
| Номер задачи | Электролит | Концентрация раствора | Плотность раствора, г/см3 |
| NH4OH | 2 % | 0,989 | |
| CH3COOH | 0,12 % | 1,0 | |
| HCOOH | 4,5 % | 1,01 | |
| CH3COOH | 2 % | 1,001 | |
| NH4OH | 2,35 % | 0,988 | |
| C6H5NH3OH | 93,02 г/л | - | |
| N2H5OH | 5 % | 1,01 | |
| C6H5OH | 5 % | 1,02 | |
| HCOOH | 0,5 % | - | |
| CH3COOH | 0,65 % | - | |
| HNO2 | 0,8 % | - | |
| HCN | 2,7 % | 1,01 | |
| C6H5OH | 9,4 г/л | - | |
| NH4OH | 0,1 % | - | |
| HCN | 8 % | 1,04 | |
| HCOOH | 2,3 % | 1,005 | |
| CH3COOH | 1 % | - |
Окончание табл.4.3
| Номер задачи | Электролит | Концентрация раствора | Плотность раствора, г/см3 |
| NH4OH | 0,34 % | 1,0 | |
| HCOOH | 3 % | 1,007 | |
| H2S | 0,32 н. | - | |
| NH4OH | 0,5 % | 1,0 | |
| H3PO4 | 1 % | 1,005 | |
| C9H7NHOH | 3 г/л | - | |
| Лимонная кислота | 120 г/л | - | |
| Бензойная кислота | 2 % | 1,003 | |
| N2H5OH | 0,5 % | - | |
| HCOOH | 4 % | 1,01 | |
| C6H5NH3OH | 0,56 г/л | - | |
| CH3NH3OH | 24,5 г/л | - | |
| C3H7NH3OH | 23,1 г/л | - | |
| C4H9NH3OH | 13,65 г/л | - | |
| C5H5NHOH | 1 г/л | - | |
| C2H5NH3OH | 0,5 г/л | - | |
| HNO2 | 2 % | 1,01 | |
| Винная кислота | 1 % | 1,02 | |
| H3BO3 | 5 % | 1,03 | |
| HBrO | 0,1 % | 1,0 | |
| H3BO3 | 10 % | 1,04 | |
| C6H5OH | 6,5 г/л | - | |
| H2S | 10 г/л | - | |
| H2CO3 | 8 % | 1,05 | |
| HF | 6 % | 1,03 | |
| C6H5СН2NH3OH | 5 г/л | - | |
| NH2OH×H2O | 6,2 г/л | - | |
| H3BO3 | 1,5 % | 1,01 | |
| (CH3)2NH2OH | 2 г/л | - | |
| (C2H5)2NH2OH | 2,8 г/л | - | |
| (CH3)3NНOH | 3 г/л | - | |
| C2H5ОNH3OH | 1,6 г/л | - | |
| CS(NH2)2×H2O | 20 г/л | - |
Задание VII. По заданному значению pH (табл.4.4) определить концентрацию предложенного раствора электролита при температуре 25 °С и выразить ее всеми возможными способами (считать, что плотность растворов 1 г/см3).
Таблица 4.4
| Номер задачи | Электролит | рН | Номер задачи | Электролит | рН |
| Сa(OH)2 | 11,0 | HClO4 | 2,35 | ||
| Сa(OH)2 | 11,8 | Ba(OH)2 | 13,8 | ||
| Ba(OH)2 | 12,8 | H2SO4 | 1,2 | ||
| KOH | 13,1 | HCl | 1,28 | ||
| H2SO4 | 1,95 | HNO3 | 3,1 | ||
| NaOH | 12,0 | KOH | 13,6 | ||
| Sr(OH)2 | 10,7 | HNO3 | 2,03 | ||
| H2SO4 | 2,2 | H2SO4 | 3,2 | ||
| HCl | 1,2 | H2SO4 | 1,5 | ||
| HCl | 2,8 | KOH | 12,03 | ||
| H2SO4 | 1,4 | Сa(OH)2 | 10,9 | ||
| LiOH | 12,5 | Ba(OH)2 | 13,3 | ||
| KOH | 13,0 | Sr(OH)2 | 10,7 | ||
| NaOH | 11,4 | H2SO4 | 1,9 | ||
| H2SO4 | 3,0 | Ba(OH)2 | 11,8 | ||
| RbOH | 13,0 | H2SO4 | 1,49 | ||
| KOH | 11,2 | HCl | 3,26 | ||
| CsOH | 12,5 | NaOH | 12,1 | ||
| HClO4 | 1,6 | H2SO4 | 2,6 | ||
| HCl | 1,95 | HCl | 2,3 | ||
| NaOH | 11,5 | HNO3 | 3,03 | ||
| H2SO4 | 1,91 | Сa(OH)2 | 11,4 | ||
| HCl | 1,56 | Ba(OH)2 | 11,1 | ||
| HNO3 | 1,41 | CsOH | 11,8 | ||
| HNO3 | 1,32 | Sr(OH)2 | 12,3 |
Задание VIII. По значению pH определить концентрацию предложенного раствора слабого электролита и выразить ее всеми возможными способами (табл.4.5).
Таблица 4.5
| Номер задачи | Электролит | рН | Плотность раствора, г/см3 | |||||
| NH4OH | 11,5 | 0,989 | ||||||
| CH3COOH | 3,23 | 1,0 | ||||||
| HCOOH | 1,9 | 1,01 | ||||||
| CH3COOH | 2,6 | 1,001 | ||||||
| NH4OH | 13,5 | 0,988 | ||||||
| C6H5NH3OH | 9,3 | 1,01 | ||||||
| N2H5OH | 10,1 | 1,01 | ||||||
| C6H5OH | 5,1 | 1,02 | ||||||
| HCOOH | 2,0 | 1,001 | ||||||
| CH3COOH | 2,9 | 1,0 | ||||||
| HNO2 | 1,9 | 1,0 | ||||||
| HCN | 4,6 | 1,01 | ||||||
| C6H5OH | 5,5 | 1,002 | ||||||
| NH4OH | 10,8 | 1,002 | ||||||
| HCN | 4,4 | 1,04 | ||||||
| HCOOH | 2,05 | 1,005 | ||||||
| CH3COOH | 2,8 | 1,0 | ||||||
| NH4OH | 11,1 | 1,0 | ||||||
| HCOOH | 2,9 | 1,007 | ||||||
| H2S | 3,9 | 1,0 | ||||||
| NH4OH | 12,0 | 1,0 | ||||||
| H3PO4 | 1,6 | 1,005 | ||||||
| C9H7NHOH | 8,7 | 1,0 | ||||||
| Лимонная кислота | 1,7 | 1,0 | ||||||
| Бензойная кислота | 2,5 | 1,003 | ||||||
| N2H5OH | 10,6 | 1,001 | ||||||
| HCOOH | 3,5 | 1,0 | ||||||
| C6H5NH3OH | 8,1 | 1,001 | ||||||
| CH3NH3OH | 12,2 | 1,001 | ||||||
Окончание табл.4.5
| Номер задачи | Электролит | рН | Плотность раствора, г/см3 | |||||
| C3H7NH3OH | 12,1 | 1,002 | ||||||
| C4H9NH3OH | 11,9 | 1,0 | ||||||
| C5H5NHOH | 10,92 | 1,0 | ||||||
| C2H5NH3OH | 8,6 | 1,0 | ||||||
| HNO2 | 1,2 | 1,01 | ||||||
| Винная кислота | 2,03 | 1,02 | ||||||
| H3BO3 | 4,7 | 1,03 | ||||||
| HBrO | 4,6 | 1,01 | ||||||
| H3BO3 | 4,9 | 1,04 | ||||||
| C6H5OH | 5,6 | 1,001 | ||||||
| H2S | 3,7 | 1,0 | ||||||
| H2CO3 | 3,1 | 1,05 | ||||||
| HF | 1,4 | 1,03 | ||||||
| C6H5NH2NH3OH | 11,0 | 1,003 | ||||||
| NH2OH×H2O | 10,4 | 1,0 | ||||||
| H3BO3 | 4,5 | 1,01 | ||||||
| (CH3)2NH2OH | 11,3 | 1,002 | ||||||
| (C2H5)2NH2OH | 11,7 | 1,0 | ||||||
| (CH3)3NHOH | 11,2 | 1,0 | ||||||
| C2H5ОNH3OH | 10,9 | 1,0 | ||||||
| CS(NH2)2×H2O | 9,0 | 1,01 | ||||||
Задание IX. Определить pH при смешивании двух растворов электролитов (табл.4.6).
Таблица 4.6
| Номер задачи | Первый раствор | Второй раствор | ||
| Объем, л | рН | Объем, л | рН | |
| 0,3 | 7,54 | 6,23 | 0,2 | |
| 0,75 | 4,07 | 5,16 | 0,55 | |
| 1,5 | 2,48 | 11,31 | 1,0 | |
| 2,5 | 3,16 | 10,05 | 1,5 | |
| 0,25 | 9,58 | 10,11 | 0,25 | |
| 1,0 | 2,56 | 11,03 | 1,5 |
Окончание табл.4.6
| Номер задачи | Первый раствор | Второй раствор | ||
| Объем, л | рН | Объем, л | рН | |
| 1,2 | 4,73 | 5,12 | 1,3 | |
| 3,0 | 1,25 | 12,32 | 2,0 | |
| 1,5 | 12,76 | 13,05 | 1,5 | |
| 0,5 | 8,76 | 6,15 | 1,0 | |
| 0,2 | 4,11 | 5,09 | 0,3 | |
| 2,2 | 3,35 | 8,65 | 0,3 | |
| 1,25 | 5,25 | 6,08 | 2,25 | |
| 0,35 | 10,17 | 4,47 | 0,16 | |
| 0,65 | 2,78 | 9,13 | 0,85 | |
| 0,25 | 6,82 | 5,47 | 0,75 | |
| 0,5 | 1,76 | 2,15 | 2,5 | |
| 1,5 | 11,83 | 10,48 | 2,5 | |
| 0,5 | 12,73 | 2,27 | 1,25 | |
| 15,0 | 2,17 | 4,21 | 3,0 | |
| 5,0 | 200,0 | |||
| 400,0 | ||||
| 5,0 | 2,31 | 4,18 | 7,2 | |
| 2,1 | 10,81 | 9,48 | 10,5 | |
| 10,1 | 9,2 | 11,2 | ||
| 0,2 | 5,48 | 6,08 | 12,8 | |
| 15,0 | 3,4 | 5,8 | 17,0 | |
| 12,3 | 13,8 | 10,54 | 20,5 | |
| 0,3 | 1,8 | 9,3 | 5,4 | |
| 1,44 | 7,5 | 8,5 | 14,4 |
Задание X. Решить задачи.
459. Смешали 10 л соляной кислоты концентрацией 3,65 г/л и 15 л гидроксида натрия концентрацией 2 г/л. Определить рН полученного раствора.
460. Найти объем раствора с рН = 3,8, если после добавления к нему 0,6 л раствора с рН = 10,5 образовался раствор с рН = 4,2.
461. Вычислить объем раствора 0,005 М соляной кислоты, если после добавления к нему 0,5 л раствора гидроксида бария концентрацией 0,003 моль/л получился раствор с рН = 4,03.
462. Определить объем раствора с рН = 10,13, если после добавления к нему 30 л раствора с рН = 9,76 образовался раствор с рН = 9,92.
463. Смешали 40 м3 раствора с рН = 6,7 и 2000 л раствора с рН = 8,3. Определить рН раствора после смешивания.
464. Определить объем раствора с рН = 13,4, если после добавления к нему 40000 л раствора с рН = 4,8 образовался раствор с рН = 8,5.
465. Определить рН раствора, если к 40 л раствора с рН = 6,7 добавили 2 л раствора с рН = 8,3.
466. Смешали 2 л серной кислоты концентрацией 0,01 моль/л и 3 л щелочи с рН = 12,5. Определить рН полученного раствора.
467. Определить объем раствора с рН = 11,3, если после добавления к нему 0,2 л раствора с рН = 2,9 и 0,5 л раствора с рН = 3,5 образовался раствор с рН = 4,1.
468. Определить объем раствора с рН = 2,14, если после добавления к нему 1,75 л раствора с рН = 11,85 образовался раствор с рН = 10,23.
469. Смешали 0,2 л 0,5 н. HCl и 0,3 л 0,3 М NaOH. Определить рН раствора после смешивания.
470. Определить объем раствора с рН = 10,13, если после добавления к нему 30 л раствора с рН = 9,76 образовался раствор с рН = 9,92.
471. Определить объем раствора с рН = 3,4, если после добавления к нему 9,8 л раствора с рН = 9,8 образовался раствор с рН = 4,6.
472. Определить рН раствора после смешивания 200 мл 0,5 н. раствора серной кислоты и 300 мл раствора едкого натра с концентрацией 0,3 моль/л.
473. Смешали 100 мл 0,015 н. раствора и 100 мл 0,09 н. раствора серной кислоты. Рассчитать рН полученного раствора.
474. Смешали 20 мл 0,5 н. раствора соляной кислоты и 10 мл 0,2 н. раствора гидроксида бария. Найти рН полученного раствора.
475. К 100 мл 0,2-процентного раствора едкого натра (NaOH) прибавили 200 мл 0,1-процентного раствора NaOH. Рассчитать рН полученного раствора.
476. К 200 мл 0,7 н. раствора серной кислоты прибавили 300 г воды. Рассчитать конечную концентрацию серной кислоты и определить рН раствора.
477. Смешали 54 мл 0,5-процентного раствора NaOH и 10 мл 0,2-процентного раствора NaOH. Рассчитать концентрацию полученного раствора и определить его рН.
478. Каким будет рН раствора, если к 500 мл 0,3-процентного раствора КОН прибавить 500 мл воды?
479. Смешали 4 мл серной кислоты концентрацией 0,46 % и 200 мл серной кислоты концентрацией 0,001 моль/л. Рассчитать рН полученного раствора.
480. Смешали 8 л раствора соляной кислоты концентрацией 0,04 моль/л и 11 л раствора ее же концентрацией 2 г/л. Рассчитать рН полученного раствора.
481. К раствору объемом 30 мл, содержащему 0,109 г серной кислоты в 100 мл раствора, прибавили 40 мл раствора NaOH, содержащего 0,098 г гидроксида натрия в 100 мл раствора. Найти концентрацию (в молях на литр) того вещества, которое останется в избытке, и вычислить рН полученного раствора.
482. Смешали 10 мл 0,12-процентного раствора HCl и 10 мл 0,076-процентного раствора HCl. Рассчитать процентную концентрацию и рН полученного раствора.
483. К 10 мл 6-процентного раствора соляной кислоты плотностью 1,03 г/см3 прибавили 10 мл 1-процентного раствора гидроксида бария плотностью 1,0 г/см3. Вычислить рН образующегося раствора.
Задание XI. Определить pH раствора после разведения (табл.4.7).
Таблица 4.7
| Номер задачи | pH исходного раствора | Разведение в n раз | Номер задачи | pH исходного раствора | Разведение в n раз | |||||||
| 10,32 | 11,47 | |||||||||||
| 2,17 | 1,55 | |||||||||||
| 1,51 | 13,44 | |||||||||||
| 2,42 | 12,7 | |||||||||||
| 3,25 | 3,45 | |||||||||||
Окончание табл.4.7
| Номер задачи | pH исходного раствора | Разведение в n раз | Номер задачи | pH исходного раствора | Разведение в n раз | |||||||
| 1,48 | 4,22 | |||||||||||
| 2,5 | 7,50 | |||||||||||
| 3,13 | 5,50 | |||||||||||
| 4,85 | 4,93 | |||||||||||
| 5,0 | 7,93 | |||||||||||
| 3,5 | 8,15 | |||||||||||
| 2,38 | 6,12 | |||||||||||
| 1,15 | 5,22 | |||||||||||
| 3,0 | 5,5 | |||||||||||
| 2,25 | 7,72 | |||||||||||
| 14,0 | 6,72 | |||||||||||
| 13,5 | 6,82 | |||||||||||
| 12,85 | 3,82 | |||||||||||
| 11,12 | 6,0 | |||||||||||
| 10,48 | 8,0 | |||||||||||
| 9,54 | 5,0 | |||||||||||
| 8,99 | 5,72 | |||||||||||
| 10,95 | 6,02 | |||||||||||
| 12,96 | 8,02 | |||||||||||
| 7,93 | 13,99 | |||||||||||
| 8,02 | 6,02 | |||||||||||
| 5,02 | 5,02 | |||||||||||
| 5,75 | 7,76 | |||||||||||
| 6,75 | 4,76 | |||||||||||
| 8,22 | 5,93 | |||||||||||
4.4. Гидролиз
Гидролиз – процесс разложения химических соединений в результате реакции с водой. Гидролиз соли – это реакция, обратная процессу образования соли путем нейтрализации кислоты основанием:
нейтрализация Þ
НА + МОН Û МА + Н2О.
кислота основание Ü гидролиз соль вода
Гидролизуются только соли, содержащие в своем составе ионы слабых электролитов: слабой кислоты или слабого основания.
Правила составления уравнений гидролиза следующие:
1. Записывают уравнение диссоциации соли.
2. Определяют ион слабого электролита, который может гидролизоваться. Ионов сильных кислот и оснований сравнительно немного, наиболее распространенные следует запомнить: анионы NO3-, SO42-, Cl-, Br-, I-, ClO4-, катионы Na+, K+ и других щелочных металлов, а также Ba2+ и Sr2+. Перечисленные ионы не гидролизуются! Все остальные ионы, за редким исключением, образуют слабые электролиты и гидролизуются.
3. Составляют ионное уравнение гидролиза по схеме:
ион слабого электролита + вода Û слабый электролит + ион,
оставшийся от молекулы воды.
4. Записывают молекулярное уравнение гидролиза, добавляя к ионам противоионы.
В зависимости от состава соли различают следующие типы гидролиза:
· Гидролиз соли, образованной сильным основанием и слабой кислотой. Гидролизуется анион слабой кислоты.
А- + Н2О Û НА + ОН-. (4.19)
В растворе появляются ионы ОН-, поэтому среда – щелочная, рН > 7.
Гидролиз соли, образованной слабым основанием и сильной кислотой. Гидролизуется катион слабого основания.
М+ + Н2О Û МОН + Н+.
В растворе появляются ионы Н+, поэтому среда кислая, рН < 7.
· Гидролиз соли, образованной двумя слабыми электролитами. Гидролиз протекает как по катиону, так и по аниону
М+ + А- + Н2О → МОН + НА.
Образующиеся слабые кислота и основание диссоциируют в разной степени, поэтому среда в растворе зависит от их относительной силы. Если кислота сильнее, то ее константа диссоциации больше и среда слабокислая. Если сильнее основание, то среда слабощелочная.
Количественные характеристики гидролиза - константа и степень гидролиза. В большинстве случаев константа гидролиза Kh не превышает 10–3 и гидролиз солей, образованных одним слабым электролитом, протекает в малой степени. Гидролиз многозарядных ионов в основном проходит по первой ступени. От значения константы гидролиза зависит рН раствора соли.
Степенью гидролиза b (аналогично степени диссоциации) называют отношение числа гидролизованных ионов к общему числу ионов слабого электролита в растворе.
Вычисление количественных характеристик гидролиза производится в зависимости от того, как образована соль:
· Соль образована одним слабым электролитом. Константа гидролиза
 , (4.20)
, (4.20)
где Kh1 – константа гидролиза по первой ступени, Kw – ионное произведение воды, при 298 K KW = 10-14; Kdn – константа диссоциации продукта гидролиза.
Константы диссоциации гидроксокомплексов металлов называют ступенчатыми константами нестойкости, их значения даны в справочнике в таблице констант нестойкости гидроксокомплексов (прил.2).
Степень гидролиза связана с константой гидролиза уравнением
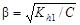 ,
,
где С – концентрация гидролизующегося иона, моль/кг.
В растворах солей, гидролизующихся по аниону, среда щелочная (см. уравнение (67)) и расчет рН ведут по формуле:
 .
.
В растворах солей, гидролизующихся по катиону, среда кислая, согласно уравнению (4.19), и расчет рН ведут по формуле
 .
.
· Соль образована двумя слабыми электролитами. Константа гидролиза
 , (4.21)
, (4.21)
где Kосн и Kк – константы диссоциации основания и кислоты, образующих соль. Формула (4.21) служит для расчета константы гидролиза по табличным значениям констант диссоциации.
Степень гидролиза
 .
.
Отношение концентраций ионов Н+ и ОН- в растворе соли определяется относительной силой кислоты и основания:
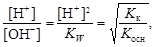
где Kк и Kосн – константы диссоциации слабых кислоты и основания, которыми образована соль.
Таким образом, при 298 К (KW = 10-14):
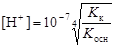
или
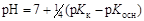 .
.
Константа и степень гидролиза у соли, образованной двумя слабыми электролитами, значительно выше, чем у солей, образованных одним слабым электролитом.
Пример 17. составить молекулярное и ионное уравнения гидролиза, указать характер среды для сульфата железа (II).
Решение. Напишем уравнение диссоциации соли: FeSO4 ® ® Fe2+ + SO42-. Определим сильный и слабый электролиты. Иону Fe2+ соответствует слабое основание Fe(OH)2, иону SO42- – сильная кислота H2SO4. Следовательно, гидролиз идет по катиону.
Составим ионное уравнение гидролиза (по первой ступени): Fe2+ + HOH ® FeOH+ + H+. В ходе гидролиза образуются ионы H+, среда кислая.
Составим молекулярное уравнение гидролиза и уравняем его как обычную реакцию обмена:
2 FeSO4 + 2H2O ® (FeOH)2SO4 + H2SO4.
Пример 18. составить молекулярное и ионное уравнения гидролиза, указать характер среды для карбоната калия.
Решение. Напишем уравнение диссоциации соли: K2CO3 ® ® K+ + CO32-. Определим сильный и слабый электролиты. Иону K+ соответствует сильное основание KOH, иону CO32- – слабая кислота H2CO3. Следовательно, гидролиз идет по аниону.
Составим ионное уравнение гидролиза (по первой ступени): CO32- + HOH ® HCO3- + OH-. В ходе гидролиза образуются ионы OH-, среда в растворе щелочная.
Составим молекулярное уравнение гидролиза и уравняем его как обычную реакцию обмена:
K2CO3 + H2O ® KHCO3 + KOH.
Пример 19. составить молекулярное и ионное уравнения гидролиза, указать характер среды для нитрита аммония.
Решение. Напишем уравнение диссоциации соли: NH4NO2 ® ® NH4+ + NO2-. Определим сильный и слабый электролит. Иону NH4+ соответствует слабое основание NH4OH, иону NO2- – слабая кислота HNO2. Следовательно, гидролиз идет как по катиону, так и по аниону. Составим ионное уравнение гидролиза:
NH4+ + NO2- + HOH ® NH4OH + HNO2.
Составим молекулярное уравнение гидролиза и уравняем его как обычную реакцию обмена:
NH4NO2 + H2O ® NH4OH + HNO2.
Пример 20. Вычислить рН раствора сульфата аммония концентрацией 0,1 моль/л.
Решение. Составим ионное уравнение гидролиза: NH4+ + H2O ® NH4OH + H+. Значение константы диссоциации гидроксида аммония Kd = 1,76×10-5. Вычислим константу гидролиза
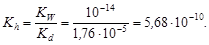
Найдем концентрацию ионов аммония. Согласно уравнению диссоциации сульфата аммония (NH4)2SO4 ® 2 NH4+ + SO42-,

Вычислим концентрацию ионов

и
рН = –lg[H+] = –lg(1,066×10-5) = 4,97.
Пример 21. вычислить степень гидролиза карбоната натрия в растворе с рН = 12.
Решение. Составим ионное уравнение гидролиза: CO32- + + H2O ® HCO3- + OH-. Вторая константа диссоциации угольной кислоты Kd2 = 4,69×10-11. Первая константа гидролиза по уравнению (4.20)

Из формулы 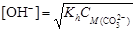 найдем концентрацию карбонат-иона
найдем концентрацию карбонат-иона
 ,
,
где [OH-] = 10-pOH = 10-(14-12) = 10-2.
Вычислим степень гидролиза
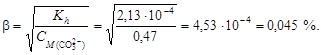
Задание XII. Составить молекулярные и ионные уравнения гидролиза, указать характер среды.
| 544. (NH4)2S 545. (NH4)2SO3 546. (NH4)3PO4 547. (ZnOH)2SO4 548. Al(NO3)3 549. Al2(SO4)3 550. Al2S3 551. AlCl3 552. Be(NO3)2 553. Ca(NO3)2 554. CdCl2 555. CH3COONH4 556. CoCl2 557. Cr(NO3)3 558. Cr2(SO4)3 559. CrCl3 560. Cs2SO4 561. CsF 562. CuSO4 563. Fe2(SO4)3 564. FeCl3 565. FeBr3 566. Ga(NO3)3 | 567. HCOOK 568. HCOONH4 569. K2SiO3 570. K2SO3 571. K3AsO4 572. KClO4 573. KCN 574. KH2AsO4 575. KHCO3 576. KMnO4 577. LiCN 578. MgCl2 579. MgSO4 580. MnCl2 581. Na2CO3 582. Na2HAsO4 583. Na2S 584. Na2SiO3 585. Na2WO4 586. Na3PO4 587. NaAlO2 588. NaCl 589. NaClO4 | 590. NaCN 591. NaH2PO4 592. NaHCO3 593. NaI 594. NaNO2 595. NH4Cl 596. NH4CNS 597. NH4HCO3 598. NH4NO2 599. NiSO4 600. Pb(CH3COO)2 601. Pb(NO3)2 602. PtCl4 603. Rb2S 604. Rb3PO4 605. Rb3SbO4 606. SbCl3 607. SnCl2 608. SnBr2 609. SnSO4 610. SrSO3 611. Zn(CH3COO)2 612. ZnBr2 |
Задание XIII. Написать в молекулярном и ионном виде реакции взаимоусиления гидролиза
613. Ацетат меди + сульфит лития.
614. Ацетат свинца + карбонат натрия.
615. Ацетат цинка + сульфит натрия.
616. Нитрат алюминия + карбонат натрия.
617. Нитрат висмута + сульфид калия.
618. Нитрат железа (III) + сульфид рубидия.
619. Нитрат свинца + карбонат стронция.
620. Нитрат серебра + карбонат натрия.
621. Нитрат хрома (III) + сульфид калия.
622. Сульфат алюминия + сульфид натрия.
623. Сульфат бария + сульфит цезия.
624. Сульфат кобальта + карбонат калия.
625. Сульфат олова + карбонат цезия.
626. Формиат алюминия + карбонат натрия.
627. Формиат меди + сульфит лития.
628. Формиат цинка + сульфид лития.
629. Фторид алюминия + карбонат калия.
630. Хлорид железа (II) + сульфид натрия.
631. Хлорид магния + сульфит рубидия.
632. Хлорид марганца + сульфит натрия.
633. Хлорид никеля + карбонат цезия.
Задание XIV. Найти неизвестные величины в предложенных задачах, дополнив табл.4.8.
Таблица 4.8
| Номер задачи | Электролит | Концентрация раствора | рН | b | Плотность раствора, г/см3 |
| Na2SO3 | 0,008 М | ? | ? | - | |
| Pb(NO3)2 | ? | 5,25 | ? | - | |
| Na2CO3 | 0,006 н. | ? | ? | - | |
| Na2C2O4 | 0,02 М | ? | ? | - | |
| Na3PO4 | 0,02 М | ? | ? | - | |
| C6H5ONa | ? | ? | 5 % | - | |
| Na2S | 0,03 М | ? | ? | - | |
| (NH4)2SO4 | ? | 5,48 | ? | - | |
| NaNO2 | 0,02 н. | ? | ? | - | |
| K2C2O4 | 0,008 М | ? | ? | - | |
| C6H5OK | ? | ? | 0,02 % | - | |
| K2HPO4 | ? | 7,5 | ? | - | |
| [NH3OН]Cl | ? | 5,5 | ? | - | |
| Na2S | 0,01 М | ? | ? | - | |
| ZnSO4 | 2 % | ? | ? | 1,019 | |
| Na2CO3 | ? | 11,2 | ? | - | |
| (CH3COO)2Ba | 0,005 М | ? | ? | - |
Окончание табл.4.8
| Номер задачи | Электролит | Концентрация раствора | рН | b | Плотность раствора, г/см3 |
| Na3PO4 | 0,03 н. | ? | ? | - | |
| CdSO4 | 3 % | ? | ? | 1,028 | |
| KCN | 0,02 М | ? | ? | - | |
| CuSO4 | 0,1 М | ? | ? | - | |
| ZnCl2 | ? | 5,84 | ? | - | |
| Na2C2O4 | 0,02 М | ? | ? | - | |
| K2HPO4 | 0,03 М | ? | ? | - | |
| HCOONa | 0,02 М | ? | ? | - | |
| Na2CO3 | ? | ? | 0,5 % | - | |
| CdSO4 | ? | 5,6 | ? | - | |
| NaBO2 | 1 г/л | ? | ? | - | |
| NaNO2 | 5 % | ? | ? | 1,01 | |
| NH4Cl | ? | 5,48 | ? | - | |
| ZnCl2 | 2 % | ? | ? | 1,016 | |
| CH3COONa | 0,01 М | ? | ? | - | |
| HCOONa | 1 % | ? | ? | 1,03 | |
| NH4Cl | % | 5,63 | ? | 1,02 | |
| KCN | 0,002 н. | ? | ? | - | |
| C6H5OK | 0,2 М | ? | ? | - | |
| HCOOK | 1 мол. % | ? | ? | 1,02 | |
| CH3COONa | ? | 8,72 | ? | - | |
| NH4Cl | ? | 5,41 | ? | - | |
| C6H5ONa | ? | ? | 5,6 % | - | |
| HCOONa | 0,01 н. | ? | ? | - | |
| NH4CN | ? | 9,175 | ? | - | |
| CH3COONH4 | ? | ? | 0,563 % | - | |
| CrCl3 | 2 % | ? | ? | 1,014 | |
| Na2Se | 11,36 % | ? | ? | 1,1 | |
| Na2SiO3 | 1 г/л | ? | ? | - | |
| Na3BO3 | 1 г/л | ? | ? | - | |
| K2GeO3 | 18,22 % | ? | ? | 1,1 | |
| NaBrO | 1 М | ? | ? | - | |
| CoCl2 | 2,6 % | ? | ? | 1,02 |
4.5. Равновесия в буферных растворах
Буферные растворы – растворы, способные поддерживать определенное значение рН при разбавлении, а также при добавлении некоторых количеств сильной кислоты или щелочи. Буферное действие основано на связывании добавляемых ионов Н+ или ОН- в молекулы малодиссоциированных соединений.
Различают следующие типы буферных растворов:
· Смесь слабой кислоты и ее соли (например, уксусная кислота СН3СООН + ацетат натрия NaCH3COO). При добавлении сильной кислоты к этому раствору анионы соли связывают ионы Н+ в молекулы малодиссоциированной уксусной кислоты:
СН3СОО- + Н+ Û СН3СООН.
При добавлении щелочи протекает реакция нейтрализации:
СН3СООН + ОН- Û СН3СОО- + Н2О
и раствор имеет
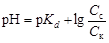 ,
,
где pKd – показатель константы диссоциации слабой кислоты, pKd = –lgKd; Сс и Ск – концентрации соли и килоты соответственно, моль/л.
· Смесь средней и кислой соли или двух кислых солей слабой многоосновной кислоты (например, Na2CO3 + NaHCO3 или Na2HPO4 + NaH2PO4). Анионы кислой соли реагируют подобно слабой кислоте:
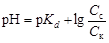 , (4.22)
, (4.22)
где Сс и Ск – концентрации кислой и средней соли соответственно, моль/л.
· Кислые соли слабых многоосновных кислот, при добавлении к растворам которых сильных кислот или щелочей, протекают аналогичные реакции:
НСО3- + Н+ Û Н2СО3;
НСО3- + ОН- Û СО32- + Н2О;
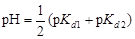 ,
,
где pKn – показатель константы диссоциации кислоты по соответствующей ступени.
· Смесь слабого основания и его соли (например, NH4OH + + NH4Cl). Буферное действие основано на реакциях
NH4OH + H+ Û NH4+ + H2O;
NH4+ + OH- Û NH4OH.
Показатель
 ,
,
где pKd – показатель константы диссоциации слабого основания; Сс и Сосн – концентрации соли и основания соответственно, моль/л.
· Соли слабых кислот и слабых оснований (например, NH4CH3COO). Буферное действие обусловлено реакциями
NH4+ + OH- Û NH4OH;
CH3COO- + H+ Û CH3COOH.
Емкостью буферного раствора Вназывают количество сильной кислоты или щелочи, которое требуется добавить к 1 л раствора для изменения его рН на единицу. Раствор утрачивает буферные свойства при добавлении сильной кислоты или щелочи в количестве, превышающем буферную емкость. Различают буферную емкость раствора по кислоте и по щелочи.
Емкость кислого буфера по щелочи вычисляют по уравнению
 .
.
Таким образом,
 (4.23)
(4.23)
Из уравнения

вычислим емкость кислого буфера по кислоте
 . (4.24)
. (4.24)
Емкости основного буфера по кислоте и по щелочи соответственно
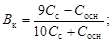
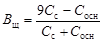 .
.
Отношение Сс/Ск или Сс/Сосн выбирают в пределах 0,1 < Сс / Ск < 10. По таблицам констант диссоциации (см. прил.1) подбирают слабую кислоту с pKd=pH ± 1(или слабое основание с pKd = pOH ± 1). Исходя из заданного рНвычисляют отношение концентраций Сс/Ск (или Сс/Сосн).
Пример 22. Вычислить изменение рН ацетатного буферного раствора, содержащего по 1 моль/л кислоты и соли, после добавления к 1 л раствора 0,1 моль соляной кислоты.
Решение. Вычислим рН данного буферного раствора по формуле (4.22):

После добавления к буферному раствору соляной кислоты концентрация ацетата натрия уменьшится, а концентрация уксусной кислоты увеличится на 0,1 моль/л вследствие протекания реакции
CH3COONa + HCl ® CH3COOH + NaCl.
Вычислив для нового раствора
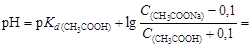

найдем ΔрН = 4,75 - 4,66 = 0,09.
Пример 23. К 0,8 л 0,5 М раствора НСООН (Kd = 1,8×10-4) добавили 0,2 л 0,4 М раствора NaOH. Вычислить рН образовавшегося формиатного буфера и его буферную емкость по кислоте и щелочи.
Решение. Количество вещества НСООН и NaOH соответственно
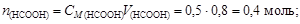
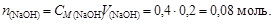
Объем буферного раствора
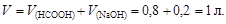
Количество вещества формиата натрия, образующегося по реакции NaOH + HCOOH ® HCOONa + H2O, 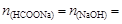
 моль. Молярная концентрация формиата натрия в буферном растворе
моль. Молярная концентрация формиата натрия в буферном растворе
 моль/л.
моль/л.
Остаточное количество вещества муравьиной кислоты
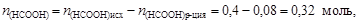
 .
.
Ее молярная концентрация в буферном растворе
 моль/л.
моль/л.
Буферный раствор имеет

Буферная емкость по кислоте согласно уравнению (4.24)

Буферную емкость по щелочи определим при помощи уравнения (4.23):
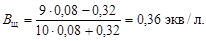
Пример 24. Сколько граммов твердого формиата натрия HCOONa надо добавить к 100 мл 0,2 М раствора соляной кислоты, чтобы получить буферный раствор с рН = 4,3?
Решение. При добавлении к раствору соляной кислоты формиата натрия образуется муравьиная кислота по реакции HCOONa + HCl ® HCOOH + NaCl. Ее концентрация
С(HCOOH) = С(HCl) = 0,2 моль/л.
Для образования формиатного буферного раствора необходима определенная концентрация формиата натрия, которую найдем исходя из формулы (4.22):
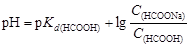 ,
,
откуда  моль/л.
моль/л.
Количество вещества формиата натрия, необходимого для получения данного буферного раствора,
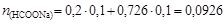 моль,
моль,
его масса
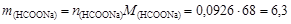 г.
г.
Задание XV. Решить задачи.
684. К 200 мл 0,5 н. раствора уксусной кислоты добавили 10 мл 0,8 н. раствора едкого натра. Определить рН полученного раствора.
685. Какой объем 20-процентного раствора уксусной кислоты плотностью 1,026 г/см3 следует прилить к 1 л 0,075 н. раствора ацетата натрия, чтобы получить буферный раствор с рН = 2,75?
686. Рассчитать рН раствора, содержащего 1,5 моль/л ацетата натрия и 0,75 моль/л уксусной кислоты. Как изменится величина рН при добавлении к 50 мл этого раствора 1 мл 2 н. раствора едкого натра?
687. Сколько граммов безводного бензойнокислого натрия необходимо прибавить к 100 мл 0,02 моль/л раствора бензойной кислоты С6Н5СООН, чтобы получить буферный раствор с рН = 5?
688. К 25 мл 2-процентного раствора гидроксида аммония плотностью 0,99 г/см3 добавили 1,5 г хлорида аммония. Определить рН полученного раствора, если его плотность равна 1,01 г/см3.
689. Как изменится рН в 0,1 н. растворе уксусной кислоты после добавления к нему кристаллического ацетата натрия до концентрации 0,1 моль/л?
690. Как изменится рН раствора, полученного смешиванием 100 мл 5-процентного раствора муравьиной кислоты плотностью 1,008 г/см3 и 100 мл 7-процентного раствора формиата калия плотностью 1,01 г/см3, если к нему прилить 50 мл 0,2 н. раствора едкого калия?
691. Какой объем 20-процентного раствора фосфорной кислоты (плотность 1,113 г/мл) надо добавить к 2 л раствора едкого кали с концентрацией 0,2 моль/л для получения буферного раствора с рН = 6?
692. Как изменится рН раствора, содержащего в 200 мл 2,14 г хлорида аммония и 2,1 г гидроксида аммония, в результате добавления к нему 10 мл 2 н. раствора соляной кислоты?
693. Какой объем раствора гидроксида бария концентрацией 0,5 моль/л следует добавить к 1,5 л 5-процентного раствора уксусной кислоты плотностью 1,006 г/см3, чтобы получить буферный раствор с рН = 4?
694. Рассчитать рН раствора, полученного смешиванием 10 м3 2-процентного раствора едкого натра (плотность 1,021 г/см3) и 15 м3 5-процентного раствора фосфорной кислоты (плотность 1,026 г/см3).
695. Какой объем 20-процентной серной кислоты (плотность 1,139 г/мл) необходимо добавить к 5 л раствора этиламина с концентрацией 0,02 моль/л для получения буферного раствора с рН = 9,8?
696. К 5 л 5-процентного раствора гидроксида аммония плотностью 0,986 г/мл добавили 10 л 3-процентного раствора серной кислоты плотностью 1,019 г/мл. Определить рН полученного раствора.
697. Определить рН борно-натриевого буферного раствора (концентрация Н3ВО3 и NaH2BO3 15 и 10 % соответственно, средняя плотность раствора 1,12 г/см3).
698. Рассчитать рН раствора, полученного путем поглощения 20 л углекислого газа 6 л раствора едкого натра с концентрацией 0,1 моль/л. Процесс вели при температуре 25 °С и давлении 1 атм.
699. Определить рН фосфорно-натриевого буфера, если в 1 л раствора содержится 19,6 г фосфорной кислоты и 30 г дигидрофосфата натрия.
700. Объем хлористого водорода, равный 5 м3, был измерен при температуре 100 °С и давлении 1,5 атм. Определить рН раствора, полученного в результате поглощения этого газа 5 м3 раствора гидроксида аммония с концентрацией 0,1 моль/л.
701. Рассчитать рН раствора, в 1 л которого содержится 12,5 г ацетата натрия и 17,5 г уксусной кислоты.
702. Какой объем аммиака должен быть поглощен при 25 °С и давлении 1 атм 2-процентным раствором серной кислоты плотностью 1,012 г/мл в количестве 300 мл, чтобы полученный раствор имел рН = 10?
703. Каков рН аммиачно-хлоридного буфера, содержащего в 1 л 70 г гидроксида аммония и 26,7 г хлорида аммония?
704. Какой объем раствора аммиака (концентрация 4,27 %, плотность 0,98 г/см3) надо добавить к 200 мл 0,1 н. раствора соляной кислоты, чтобы получить буферный раствор с рН = 8,24?
705. Рассчитать рН смеси карбоната и гидрокарбоната калия с концентрацией по 0,02 моль/л.
706. Какой объем раствора уксусной кислоты (концентрация 6 %, плотность 1,007 г/см3) следует долить к 100 мл раствора едкого натра (концентрация 0,6 %, плотность 1,005 г/см3), чтобы получить буферный раствор с рН = 4,18?
707. Рассчитать рН раствора дигидрофосфата натрия с концентрацией 1 моль/л.
708. Сколько граммов гипобромита натрия NaBrO следует добавить к 10 л 0,5 н. раствора бромноватистой кислоты, константа диссоциации которой равна 2,06×10-9, чтобы получить буферный раствор с рН = 6,74?
709. Рассчитать рН раствора гидросульфида калия с концентрацией 1 моль/л.
710. Какой объем аммиака должен быть поглощен при 25 °С и давлении 1 атм 2-процентным раствором соляной кислоты (плотность 1,008 г/см3) в количестве 300 мл, чтобы полученный раствор имел значение рН = 10?
711. Каково значение рН аммиачно-хлоридного буфера, содержащего в 1 л 70 г гидроксида аммония и 26,7 г хлорида аммония?
712. Как изменится рН СН3СООН в 0,2 М растворе, если к 100 мл этого раствора прибавили 30 мл 0,3 М раствора ацетата натрия?
713. Рассчитать рН полученного раствора, если к 100 мл 0,0375 М СН3СООН прибавили 0,102 г CH3COONa.
714. Вычислить рН раствора, полученного смешиванием 25 мл 0,2 М СН3СООН и 15 мл 0,1 М CH3COONa.
715. Вычислить рН полученного раствора, если в 1 л воды содержится 60,05 г СН3СООН и 82,03 г CH3COONa.
716. Вычислить рН раствора, если к 2 л воды прибавили 23 г НСООН и 21 г НСООК.
717. Вычислить рН раствора, полученного смешиванием 15 мл 0,1 М НСООН и 12 мл 0,2 М HCOONa.
718. Какой объем 0,2 М NaOH надо прибавить к 40 мл 0,1 М раствора лимонной кислоты, чтобы получить раствор с рН = 3,0?
719. Какой объем раствора NaOH (концентрация 0,4 %) надо прибавить к 23 мл 0,2 М раствора ортофосфорной кислоты, чтобы получить раствор с рН = 2,3?
720. Какую массу гидроксида натрия надо растворить в 100 мл 0,1 М раствора гидрокарбоната натрия, чтобы получить раствор с рН = 10?
721. Какую массу гидрокарбоната натрия надо растворить в 30 мл раствора гидроксида натрия (концентрация 1 %), чтобы получить раствор с рН = 10,0?
722. Как изменится рН 1-процентного раствора НСООН, если к 230 мл этого раствора прибавить 540 мл раствора НСООK концентрацией 0,5 %?
723. Сколько миллилитров 0,2 М HCl надо добавить к 50 мл 0,1 М Na2CO3, чтобы получить раствор с рН = 10,5?
4.6. Равновесия в насыщенных растворах
Насыщенным называют раствор, находящийся в равновесии с избытком растворяемого вещества. Концентрацию насыщенного раствора называют растворимостью и обозначают S. Растворимость зависит от температуры и состава раствора.
Рассмотрим равновесие между солью, состоящей из катионов металла Mz+ и анионов кислотного остатка Az-, и ее насыщенным раствором. При этом учтем, что все соли – сильные электролиты, полностью диссоциирующие в растворе:
Мn+Аn-(т) Û n+Мz+(р-р) + n-Аz-(р-р). (4.25)
Константу данного равновесия называют произведением растворимости соли и обозначают L. Согласно закону действующих масс
L = [Mz+]n+[Az-]n-. (4.26)
Это выражение используют для расчета концентрации ионов в насыщенных растворах. Значения произведений растворимости обычно берут в справочнике (прил.3).
Бинарная система соль – вода. Согласно уравнению (4.25), [Mz+] = n+S и [Az-] = n-S. Подставив эти соотношения в (4.26), получим
L = (n+S)n+(n-S)n- = (n±S)n,
где n± = (n+n+×n-n-)1/n; n = n+ + n-.
Таким образом, растворимость соли в воде
 .
.
Многокомпонентная система с одноименными ионами. Рассмотрим расчет растворимости соли Мn+Аn- в системе, содержащей хорошо растворимую соль М¢Аn¢ с одноименным анионом (например, BaSO4–Na2SO4–H2O). Катионы Mz+переходят в раствор только из осадка, поэтому их концентрация определена растворимостью: [Mz+] = n+S. Концентрация анионов в растворе складывается из двух составляющих: растворимости труднорастворимой соли n-S и концентрации соли М¢An¢, которую обозначим n¢С¢. После подстановки в формулу (4.26) запишем
L = (n+S)n+(n-S + n¢C¢)n-. (4.27)
Растворимость находят путем решения степенного уравнения (4.27). Если растворимость меньше концентрации соли с одноименным ионом в 100 раз и более, т.е. n-S < 0,01n¢C¢, то пренебрегают меньшим слагаемым в сумме и получают
 .
.
Аналогично вычисляют растворимость в присутствии одноименного катиона. Следует запомнить, что растворимость в присутствии одноименных ионов всегда понижается.
Условия образования осадков. Если произведение концентраций ионов, образующих труднорастворимую соль, выше равновесного значения, т.е. правая часть в формуле (4.26) больше левой, то в системе образуется осадок. При противоположном знаке неравенства осадок будет растворяться.
Значение рН, при котором из данного раствора начинает выпадать осадок гидроксида, называют рН гидратообразования. Для расчета этой характеристики используют формулы
М(ОН)z(т) Û Мz+(р-р) + zOH-(р-р);
L = [Mz+][OH-]z. (4.28)
Из формулы (4.28) находят концентрацию ионов гидроксила, а затем рН гидратообразования.
Пример 25. Рассчитать растворимость флюорита CaF2 в воде и в растворе NaF (концентрация 0,1 моль/л).
Решение. 1. Запишем уравнение диссоциации CaF2, отвечающее равновесному растворению флюорита:
CaF2(т) ® Сa2+(p-p) + 2F-(p-p),
согласно которому [Ca2+] = S; [F-] = 2S.
Составим уравнение произведения растворимости CaF2
L = [Ca2+][F-]2 = S×(2S)2 = 4S3,
из которого растворимость флюорита в воде
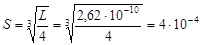 моль/л.
моль/л.
2. Для расчета растворимости в растворе NaF, которую обозначим S1, произведем следующие подстановки в уравнение произведения растворимости L = [Ca2+][F-]2: [Ca2+] = S1; [F-] = 2S1 + + CNaF = 0,1 моль/л, так как S1 << 0,1. Тогда L = S1(0,1)2, откуда
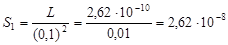 моль/л.
моль/л.
Пример 26. Вычислить рН гидратообразования для раствора сульфата никеля с концентрацией 0,01 моль/л ( = 1,2×10-16).
= 1,2×10-16).
Решение. Осадок гидроксида образуется из раствора NiSO4 в результате установления следующего равновесия:
Ni(OH)2 ® Ni2+ + 2OH-.
Гидратообразование начинается при условии [Ni2+]×[OH-]2 = L, откуда

рОН = -lg[OH-] = -lg1,09×10-7 = 6,96;
рH = 14 – рОН = 7,04.
Пример 27. Произойдет ли осаждение малорастворимого AgNO2 (L = 1,6×10-4) по реакции AgNO3 + KNO2 ® AgNO2 + KNO3 при смешивании равных объемов растворов AgNO3 и KNO2 (концентрация растворов 0,02 М)?
Решение. Для образования осадка AgNO2 должно выполняться условие [Ag+][NO2-] ≥ L. Проверим, выполняется ли это условие. После смешивания равных объемов растворов AgNO3 и KNO2 общий объем раствора будет в 2 раза больше каждого из исходных, и концентрации AgNO3 и KNO2 соответственно уменьшатся в 2 раза, т.е. будут равны 0,01 моль/л. Так как [Ag+][NO2-] = 0,01×0,01 = 1×10-4 < L, осадок не образуется.
Задание XVI. Вычислить растворимость предложенного соединения в воде при температуре 25 °С и в присутствии электролита с одноименным ионом (табл.4.9).
Таблица 4.9
| Номер задачи | Твердая фаза | Электролит | Концентрация раствора |
| AgBr | AgNO3 | 0,01 г/л | |
| Ag2SO4 | K2SO4 | 0,01 М | |
| PbI2 | KI | 0,05 н. | |
| CaCO3 | Na2CO3 | 0,005 н. | |
| BaCrO4 | K2CrO4 | 0,001 М | |
| BaSO4 | BaCl2 | 0,001 г/л | |
| Ag2CO3 | Na2CO3 | 0,1 % | |
| CaSO4 | K2SO4 | 0,02 % | |
| PbBr2 | KBr | 0,003 н. | |
| PbSO4 | Pb(NO3)2 | 0,005 М. | |
| ZnS | ZnCl2 | 0,09 г/л | |
| Hg2SO4 | Na2SO4 | 0,001 г/л | |
| PbCO3 | K2CO3 | 0,02 г/л | |
| BaSO3 | Na2SO3 | 0,028 М | |
| AgIO3 | KIO3 | 0,009 н. | |
| CaHPO4 | CaCl2 | 0,01 г/л | |
| CuI | KI | 0,01 М | |
| TlI | NaI | 0,05 н. | |
| Hg2I2 | Hg2(NO3)2 | 0,005 н. | |
| Ag2S | AgNO3 | 0,001 М | |
| TlBr | NaBr | 0,001 г/л | |
| BaSO3 | Na2SO3 | 0,003 н. | |
| Ag3PO4 | AgNO3 | 0,005 М. | |
| PbS | Pb(NO3)2 | 0,09 г/л | |
| CaF2 | NaF | 0,001 г/л | |
| LaF3 | NaF | 0,02 г/л | |
| Ca3(PO4)2 | CaCl2 | 0,028 М | |
| Na3AlF6 | NaCl | 0,1 % | |
| AgBrO3 | NaBrO3 | 0,02 % | |
| AgCl | KCl | 0,003 н. | |
| AgI | KI | 0,005 М. | |
| Ag2CrO4 | AgNO3 | 0,09 г/л |
Окончание табл.4.9
| Номер задачи | Твердая фаза | Электролит | Концентрация раствора |
| CdCO3 | Cd(NO3)2 | 0,001 г/л | |
| CuCl | KCl | 0,02 г/л | |
| Hg2Br2 | KBr | 0,028 М | |
| Hg2Cl2 | KCl | 0,009 н. | |
| PbCl2 | KCl | 0,01 г/л | |
| TlCl | KCl | 0,01 М | |
| Ba3(AsO4)2 | Ba(NO3)2 | 0,05 н. | |
| Ba3(PO4)2 | K3PO4 | 0,005 н. | |
| Bi2(C2O4)3 | Bi(NO3)3 | 0,001 М | |
| Li3PO4 | K3PO4 | 0,001 г/л | |
| In4[Fe(CN)6]3 | K4[Fe(CN)6] | 0,003 н. | |
| Na2BeF4 | NaNO3 | 0,01 г/л | |
| K2SiF6 | KNO3 | 0,01 М | |
| Hg2CrO4 | Hg2(NO3)2 | 0,05 н. | |
| SnS | Na2S | 0,0005 н. | |
| Pb3(PO4)2 | K3PO4 | 0,01 М | |
| Tl2S | Na2S | 0,0005 н. | |
| Zn3(AsO4)2 | ZnSO4 | 0,009 н. |
Задание XVII. Определить рН гидратообразования предложенных солей (табл.4.10).
Таблица 4.10
| Номер задачи | Соль | Концентрация соли, моль/л | Номер задачи | Соль | Концентрация соли, моль/л |
| AlCl3 | 0,01 | CdCl2 | 0,15 | ||
| MgCl2 | 0,38 | Sb(NO3)3 | 0,002 | ||
| Be(NO3)2 | 0,52 | CoSO4 | 0,006 | ||
| MnSO4 | 0,062 | Sc(NO3)3 | 0,001 | ||
| Bi(NO3)3 | 0,046 | Cr2(SO4)3 | 0,059 | ||
| NiCl2 | 0,031 | SnCl2 | 0,012 | ||
| CaCl2 | 0,023 | Cu(NO3)2 | 0,038 | ||
| Pb(NO3)2 | 0,004 | SnCl4 | 0,003 |
Окончание табл.4.10
| Номер задачи | Соль | Концентрация соли, моль/л | Номер задачи | Соль | Концентрация соли, моль/л |
| FeSO4 | 0,064 | LaCl3 | 0,008 | ||
| Sr(NO3)2 | 0,055 | Y(NO3)3 | 0,0012 | ||
| FeCl3 | 0,26 | ZrOCl2 | 0,056 | ||
| Tl(NO3)3 | 0,001 | ZnSO4 | 0,022 |
Задание XVIII. Решить задачи.
798. Определить концентрацию карбоната натрия, необходимую для того, чтобы снизить растворимость карбоната серебра в 100 раз по сравнению с растворимостью в воде.
799. Чему равно произведение растворимости и растворимость иодида серебра в воде, если концентрация иодида серебра в 0,001 н. растворе иодида калия равна 1,5×10-13 моль/л?
800. Во сколько раз меньше растворимость гидроксида кобальта (II) в растворе с рН = 12, чем в растворе с рН = 10?
801. Какое из оснований – гидроксид железа (II) или гидроксид железа (III) – и во сколько раз лучше растворимо в щелочном растворе с рН = 9?
802. Определить растворимость и произведение растворимости гидроксида кальция, если его насыщенный раствор имеет рН = 12,4.
803. Определить растворимость гидроксида никеля в воде и в растворе с рН = 1.
804. При каком значении рН растворимость гидроксида кадмия снизится в 20 раз по сравнению с растворимостью в воде?
805. Определить произведение растворимости и растворимость в воде сульфата кальция, если концентрация соли в 0,2 н. растворе серной кислоты составляет 6×10-5 моль/л.
806. Определить произведение растворимости и растворимость сульфата свинца в воде, если концентрация соли в 0,004 н. растворе серной кислоты равна 8×10-6 моль/л.
807. Во сколько раз растворимость хлорида серебра в 0,001 н. растворе хлорида натрия меньше, чем в воде?
808. Определить растворимость гидроксида кобальта (II) в воде и в 0,1 н. растворе сульфата кобальта.
809. Определить растворимость гидроксида железа (II) в воде и в 0,05 М растворе сульфата железа (II).
810. Смешаны равные объемы 0,02 н. растворов хлорида кальция и сульфата натрия. Образуется ли при этом осадок сульфата кальция?
811. Во сколько раз растворимость оксалата кальция Са2С2О4 в 0,1 М растворе оксалата аммония меньше, чем в воде?
812. Во сколько раз уменьшится концентрация ионов серебра в насыщенном растворе хлорида серебра, если прибавить к нему столько соляной кислоты, чтобы концентрация хлорид-ионов в растворе стала равной 0,03 моль/л?
813. Растворимость бромида таллия (I) в воде 1,9×10-3 моль/л. Определить его произведение растворимости и растворимость в 0,1 н. растворе нитрата таллия (I).
814. Растворимость карбоната кальция в воде составляет 4,15×10-6 моль/л. Определить его произведение растворимости и растворимость в 0,001 М растворе карбоната натрия.
815. К 150 мл насыщенного раствора AgCl прибавили 10 мл раствора NaCl концентрацией 3 %. Сколько молей серебра останется в растворе?
816. К 125 мл насыщенного раствора PbSO4 прибавлено 5 мл раствора H2SO4 концентрацией 0,5 %. Сколько молей свинца останется в растворе?
817. К 20 мл Na2AsO4 прилили 30 мл 0,12 М раствора AgNO3. Какая масса мышьяка останется в растворе?
818. К 50 мл 0,02 М раствора CaCl2 прибавили 50 мл 0,03 М раствора сульфата калия. Какова остаточная концентрация сульфата кальция?
819. Выпадет ли осадок Mg(OH)2 при действии на 0,2 М раствор сульфата магния равным объемом 0,2 М раствора гидроксида аммония?
820. Насыщенный раствор CaSO4 смешали с равным объемом раствора, содержащего 0,0248 г (NH4)2C2O4 в 1 л. Произойдет ли образование осадка CaC2O4?
821. При какой концентрации ионов магния начнется выпадение осадка Mg(OH)2 из раствора, имеющего рН = 8,7?
822. При какой концентрации хромат-ионов начнется выпадение осадка PbCrO4 из 0,1 М раствора нитрата свинца (II)?
823. Будет ли осаждаться SrSO4 при добавлении 5 мл насыщенного раствора сульфата кальция к 20 мл раствора, содержащего 0,5 экв кальция?
824. В 200 мл раствора содержится по 0,02 экв хлорида и оксалата натрия. К раствору добавляют нитрат серебра. Какова будет остаточная концентрация хлорид-ионов и когда начнется осаждение Ag2C2O4?
825. Какое вещество начнет осаждаться первым при постепенном приливании нитрата серебра к раствору, в 1 л которого содержится 0,01 моль KCl и 0,1 моль K2CrO4?
826. В 100 мл раствора содержится 0,01 экв. ионов Ba2+ и Sr2+. Сколько молей K2CrO4 следует ввести в раствор, чтобы осадить барий?
827. В 100 мл раствора содержится 0,01 экв. ионов Sr2+. Сколько молей K2CrO4 следует ввести в раствор, чтобы осадить стронций?
5. Окислительно-восстановительные реакции
Окислительно-восстановительными называются химические реакции, сопровождающиеся изменением степени окисления атомов элементов.
Окисление – процесс отдачи электронов, а восстановление – процесс принятия электронов. Окисление и восстановление взаимосвязаны.
Окислитель – вещество, атомы которого принимают электроны, при этом он восстанавливается.
Восстановитель – вещество, атомы которого отдают электроны, при этом он окисляется.
Все окислительно-восстановительные реакции классифицируют следующим образом:
· Межмолекулярные реакции. Это реакции, в которых окислитель и восстановитель являются различными веществами:
 ;
;

где Mn+4 – окислитель; Cl–1 – восстановитель.
· Реакции внутримолекулярного окисления. Это реакции, которые протекают с изменением степеней окисления атомов различных элементов одного и того же вещества:
 ,
,

где Mn+7 – окислитель; O-2 – восстановитель.
· Реакции диспропорционирования. В этих реакциях и окислителем, и восстановителем является элемент, находящийся в промежуточной степени окисления в составе одного и того же вещества:
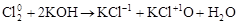 ,
,
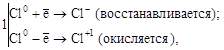
где Cl20 – окислитель и восстановитель.
О возможности того или иного вещества проявлять окислительные, восстановительные или двойственные свойства можно судить по степени окисления элементов, выполняющих эти функции.
Элементы в своей высшей степени окисления проявляют только окислительные свойства, а в низшей степени окисления проявляют только восстановительные свойства. Элементы, имеющие промежуточную степень окисления, могут проявлять как окислительные, так и восстановительные свойства. Некоторые окислители и восстановители представлены в табл.5.1.
Таблица 5.1
| Вещество | Схемы реакций | |||
 KMnO4 KMnO4
|  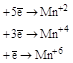 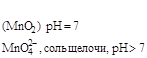
| |||
|  
| |||
| H2O2 | 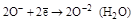
| |||
| Восстановители | Схемы реакций | |||
| H2S и ее соли, Na2S2O3 | 
| |||
| НГ и их соли | 
| |||
 Cr+3 Cr+3
| 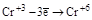 
| |||
| HNO2 и ее соли |  (HNO3 или ее соли) (HNO3 или ее соли)
| |||
| H2SO3 и ее соли |  (H2SO4 или ее соли) (H2SO4 или ее соли)
| |||
| H2O2 | 
| |||
Пример 1. составить электронную схему и закончить уравнение реакции FeSO4 + K2Cr2O7 + H2SO4 → …
Решение. Степени окисления изменяются у железа Fe+2 и хрома Cr+6. Составим уравнение баланса электронов, причем расчет ведем на два атома хрома (по числу атомов в молекуле K2Cr2O7):
| 6 Fe+2 – ē → Fe+3 | |
| 1 2Cr+6 + 6ē → 2Cr+3 | |
| 6 Fe2+ + 2 Cr+6 → 2 Cr+3 + 6 Fe+3 |
Расставим полученные коэффициенты в левую и правую части исходного уравнения. Учитывая, что реакция протекает при избытке серной кислоты, конечным продуктом реакции будут сульфаты всех металлов. Водород образует воду. Недостаток сульфат-ионов слева компенсируют 7 моль серной кислоты. В последнюю очередь уравнивают реакцию по водороду (7 Н2О). Проверку следует вести по кислороду (по 59 атомов слева и справа).
Окончательно
6 FeSO4 + K2Cr2O7 + 7 H2SO4 →
→ 3 Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + 7 H2O.
Пример 2.Закончить и уравнять реакцию С6Н12О6 + + КМnО4 + Н2SО4 → СО2 + …
Решение. Необходимо составить схему процесса. В кислой среде перманганат-ион восстанавливается до иона марганца со степенью окисления +2. Для уравнивания числа атомов кислорода добавляют воду или ионы Н+ в кислой среде или ОН- в щелочной:
МnО4- + 8 Н+ + 5 e- → Мn2+ + 4 Н2О.
Восстановитель С6Н12О6 окисляется до СО2 согласно полуреакции:
С6Н12О6 + 6 Н2О - 24 e- → 6 СО2 + 24 Н+.
Приведем число электронов к наименьшему общему кратному, в данном случае к 120. Для этого уравнения полуреакций умножим на соответствующие коэффициенты: на 24 и 5. Суммируем уравнения полуреакций, сокращая одинаковые члены в левой и правой частях. В результате получим ионное уравнение реакции
5 С6Н12О6 + 24 МnО4- + 72 Н+ → 30 СО2 + 24 Мn2+ + 66 Н2О.
Составим молекулярное уравнение реакции путем добавления к ионам имеющихся в растворе противоионов:
5 С6Н12О6 + 24 КМnО4 + 36 Н2SO4 =
= 30 СО2 + 24 МnSO4 + 66 Н2О + 12 К2SО4.
Задание I. Дописать схемы окислительно-восстановительных реакций и расставить коэффициенты в уравнениях.
1. MnO2 + KClO3 + KOH → K2MnO4 + KCl + …
2. HgS + HNO3 + HCl → S + NO + …
3 SO2 + Br2 + H2O → H2SO4 + …
4. Mn(OH)2 + Cl2 + KOH → MnO2 + KCl + …
5. K[Cr(OH)4] + Br2 + KOH → K2CrO4 + …
6. Cl2 + S + H2O → H2SO4 + …
7. K2MnO4 + Cl2 → KMnO4 + …
8. KNO3 → KNO2 + O2 + …
9. AgNO3 → Ag + NO2 + O2 + …
10. Pb(NO3)2 → PbO + NO2 + O2 + …
11. NO2 + H2O → HNO3 + NO + …
12. Ca(OH)2 + NO2 → Ca(NO3)2 + Ca(NO2)2 + …
13. KClO3 → KClO4 + KCl + …
14. I2 + Ba(OH)2 → Ba(IO3) 2 + BaI2 + …
15. H2S + O2 → SO2 + …
16. S + HNO3 → H2SO4 + NO2 + …
17. C + HNO3(K) → CO2 + NO + …
18. NH3 + O2 → NO + …
19. H2O2 + KMnO4 + H2SO4 → O2 + …
20. K3[Cr(OH)6] + Br2 + KOH → K2CrO4 + …
21. H2S + K2Cr2O7 + H2SO4 → S + …
22. KNO2 + KMnO4 + H2O → KNO3 + …
23. KNO2 + KMnO4 + KOH → KNO3 + …
24. K4[Fe(CN)6] + H2O2 + H2SO4 → K3[Fe(CN)6] + …
25. K3[Fe(CN)6] + H2O2 + KOH →K4[Fe(CN)6] + O2 + …
26. Zn + KClO3 + KOH → K2[Zn(OH)4] + KCl + …
27. Al + KNO3 + KOH → K3[Al(OH)6] + NH3 + …
28. Al + NaOH + H2O → Na3[Al(OH)6] + …
29. K2[Sn(OH)4] + KOH + Bi(NO3)3 → K2[Sn(OH)6] + Bi + …
30. SnCl2 + HCl + HNO3 → H2[SnCl6] + NO + …
31. SnCl2 + HgCl2 + HCl → Hg + H2[SnCl6] + …
32. KNO2 + KMnO4 + H2SO4 → KNO3 + …
33. Cu2O + HNO3 → NO2 + …
34. FeSO4 + KClO3 + H2SO4 → KCl + …
35. CuCl2 + SO2 + H2O → CuCl + …
36. CrCl3 + Br2 + KOH → K2CrO4 + …
37. H2O2 + KI + H2SO4 → I2 + …
38. H2S + H2O2 → H2SO4 + …
39. H2S + H2SO3 → …
40. H2O2 + HIO3 → I2 + …
41. H2O2 + K2Cr2O7 + H2SO4 →…
42. K2Cr2O7 + H2S + H2SO4 → SO2 + …
43. Hg2(NO3)2 + O2 + HNO3 → Hg(NO3)2 + …
44. NaCrO2 + H2O2 + NaOH → Na2CrO4 + …
45. HBr + HBrO3 → Br2 + …
46. HClO + H2O2 → HCl + …
47. CrO3 + HCl → Cl2 + …
48. PH3 + KMnO4 + H2SO4 → H3PO4 + …
49. NaBr + NaBrO3 + H2SO4 → Br2 + …
50. SnS + HNO3 → NO + …
51. HgI2 + H2O2 + H2SO4 → I2 + …
52. KMnO4 + MnSO4 + H2O → MnO2 + …
53. H2MnO4 → HMnO4 + MnO2 + …
54. Hg + HNO3(в.р.) → NH3 + …
55. K2Cr2O7 + SnCl2 + HCl → K2[SnCl6] + …
56. Na[Cr(OH)4] + NaClO3 + NaOH → Na2CrO4 + NaCl + …
57. FeS2 + HNO3 → Fe(NO3)3 + NO + …
58. Fe3O4 + HNO3 → Fe(NO3)3 + NO + …
59. Fe3O4 + H2SO4 → Fe2(SO4)3 + SO2 + …
60. CuFeS2 + HNO3 → FeSO4 + CuSO4 + NO + …
61. As2S2 + HNO3 → H3AsO4 + H2SO4 + NO + …
62. Zn + HNO3(в.р.) → N2 + Zn(NO3)2 + …
63. SnCl2 + Cl2 + KOH → …
64. MnSO4 + Br2 + H2O → HMnO4 + …
65. FeSO4 + KBrO3 + H2SO4(pазб) → …
66. Fe(OH)3 + Cl2 + KOH → KClO3 + …
67. HClO + KI → …
68. HClO + H2S → …
69. HClO4 + H2SO3 → …
70. HClO4 + C → …
71. K2S + KMnO4 + H2SO4(разб.) → …
72. P + KOH + H2O → K2HPO4 + …
73. NO2 + KOH → KNO3 + …
74. K2MnO4 + H2SO4(разб.) → MnO2 + KMnO4 + …
75. MnSO4 + NaBiO3 + H2SO4(разб.) → …
76. KMnO4 + NaI + H2O → …
77. MnSO4 + PbO2 + HNO3 → HMnO4 + …
78. MnSO4 + KClO3 + H2O → HMnO4 + …
79. KMnO4 + H2O2 + H2O → …
80. SnCl2 + NaBiO3 + HClp → SnCl4 + …
81. Cl2 + I2 + H2O → …
82. HBrO + HBr → …
83. Ca(ClO2)2 + NaI + H2SO4 → …
84. NaClO + Na2S + H2SO4(разб.) → …
85. NaIO3 + Cl2 + KOH → …
86. KClO3 + S → …
87. NaClO3 + MnO2 + NaOH → Na2MnO4 + …
88. H2O2 + NaI → …
89. H2O2 + CrCl3 + KOH → K2CrO4 + …
90. H2O2 + KMnO4 → MnO2 + …
91. H2O2 + K2Cr2O7 + HClp → …
92. H2S + KMnO4 + H2O → …
93. SO2 + KMnO4 + H2O → …
94. SO2 + K2Cr2O7 + H2SO4(разб.) → …
95. SO2 + Br2 + H2O → …
96. H2SO4(конц.) + Mg → H2S + …
97. H2O2 + SO2 → …
98. H2S + SO2 + NaOH → …
99. PH3 + KMnO4 + H2SO4(разб.) → H3PO4 + …
100. P + KOH → …
Задание II. Написать уравнения окислительно-восстановительных реакций между указанными веществами в серно-кислой (задачи 101-135), соляно-кислой (задачи 136-149), щелочной NaOH KOH (задачи 150-180) и нейтральной (задачи (181-200) средах. Расставить коэффициенты, пользуясь методом ионно-электронного баланса.
101. Перманганат калия и сульфит калия.
102. Перманганат и нитрит калия.
103. Перманганат и гидросульфит калия.
104. Перманганат калия и сульфит железа (II).
105. Перманганат калия и сульфит олова (II).
106. Перманганат калия и пероксид водорода.
107. Перманганат калия и сульфид калия.
108. Перманганат калия и сероводород.
109. Перманганат калия и соляная кислота (концентрированная).
110. Перманганат калия и бромисто-водородная кислота.
111. Перманганат калия и бромисто-водородная кислота.
112. Перманганат калия и иодид калия.
113. Перманганат калия и бромид калия.
114. Перманганат кальция и сульфит калия.
115. Перманганат кальция и хлорид олова (II).
116. Перманганат кальция и нитрит калия.
117. Дихромат калия и сульфит калия.
118. Дихромат калия и нитрит калия.
119. Дихромат калия и сульфат железа (II).
120. Дихромат калия и сульфат олова (II).
121. Дихромат калия и пероксид водорода.
122. Дихромат калия и сульфид натрия.
123. Дихромат калия и диоксид серы.
124. Дихромат калия и бромисто-водородная кислота.
125. Дихромат калия и иодисто-водородная кислота.
126. Дихромат калия и бромид калия.
127. Дихромат калия и иодид калия.
128. Дихромат калия и гидросульфит калия.
129. Хромат калия и сульфит калия.
130. Хромат калия и нитрит калия.
131. Манганат калия и сульфид калия.
132. Манганат калия и иодид калия.
133. Манганат калия и бромид калия.
134. Хлорат калия и сульфат железа (II).
135. Хлорат калия и сульфат олова (II).
136. Переманганат калия и сульфит олова (II).
137. Переманганат калия и хлорид железа (II).
138. Переманганат калия и хлорид олова (II).
139. Дихромат калия и хлорид олова (II).
140. Дихромат калия и соляная кислота (концентрированная).
141. Хромат калия и соляная кислота (концентрированная).
142. Хромат калия и хлорид олова (II).
143. Манганат калия и соляная кислота (концентрированная).
144. Хромат калия и соляная кислота (концентрированная).
145. Бромат калия и хлорид железа (II).
146. Бромат калия и хлорид олова (II).
147. Иодат калия и хлорид олова (II).
148. Диоксид марганца и хлорид железа (II).
149. Диоксид марганца и хлорид олова (II).
150. Иод и бромид олова (II).
151. Перманганат калия и хлорид олова (II).
152. Перманганат калия и сульфат олова (II).
153. Гипохлорит натрия и сульфат олова (II).
154. Гипобромит калия и хлорид олова (II).
155. Гипоиодит калия и сульфат олова (II).
156. Пероксид водорода и алюминий.
157. Бром и сульфат олова (II).
158. Хлор и хлорид олова (IV).
159. Фтор и хлорид олова (IV).
160. Иод и сульфит натрия.
161. Бром и сульфит натрия.
162. Хлор и сульфит натрия.
163. Фтор и сульфит калия.
164. Иод и сера.
165. Пероксид водорода и сера.
166. Гипоиодид калия и алюминий.
167. Гипоиодит бария и алюминий.
168. Пероксид водорода и алюминий.
169. Хлор и сера.
170. Метахромит калия и бром.
171. Сурьма и бром.
172. Арсин и иод.
173. Хлорат натрия и оксид марганца (IV).
174. Иодат калия и хлор.
175. Сероводород и оксид серы (IV).
176. Хлорид олова (II) и хлор.
177. Сульфат хрома (II) и бром.
178. Метахромит натрия и оксид свинца (II).
179. Сульфат марганца (II) и бром.
180. Метахромит марганца (II) и пероксид водорода.
181. Оксид серы (IV) и бром.
182. Сера и хлор.
183. Сероводород и хлор.
184. Перманганат калия и сульфит калия.
185. Пермангнат калия и нитрит кальция.
186. Перманганат калия и оксид азота (IV).
187. Оксид серы (IV) и ортомышьяковая кислота.
188. Гидроксид никеля (II) и гипохлорит натрия.
189. Хлорная кислота и оксид серы (IV).
190. Сульфит железа (III) и оксид серы (IV).
191. Сульфит калия и бром.
192. Перманганат калия и сульфат марганца (II).
193. Метахромит калия и пероксид водорода.
194. Гидроксид железа (II) и кислород.
195. Алюминий и гидроксид натрия.
196. Перманганат калия и сульфат хрома (III).
197. Перманганат калия и иодид калия.
198. Пермангнат калия и пероксид водорода.
199. Сульфит калия и сероводород.
200. Нитрит натрия и иодид калия.
Приложение 1
Константы диссоциации некоторых слабых кислот и оснований
Окончание прил.1 Название Химическая формула Kd …Приложение 2
Константы нестойкости гидроксокомплексов
Приложение 3
Произведения растворимости
Окончание прил.3
СОДЕРЖАНИЕ
1. ОСНОВНЫЕ КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ. НОМЕНКЛАТУРА 3
2. СТРОЕНИЕ АТОМА.......................................................................................... 15
3. ОСНОВНЫЕ ПОНЯТИЯ И ЗАКОНЫ ХИМИИ............................................ 21
4. РАСТВОРЫ......................................................................................................... 44
4.1. Концентрации растворов............................................................................ 44
4.2. Коллигативные свойства растворов.......................................................... 59
4.3. Водородный показатель............................................................................. 70
4.4. Гидролиз...................................................................................................... 86
4.5. Равновесия в буферных растворах............................................................ 95
4.6. Равновесия в насыщенных растворах........................................................ 103
5. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ.................... 111
Приложение 1. Константы диссоциации некоторых слабых кислот и оснований 120
Приложение 2. Константы нестойкости гидроксокомплексов.............................. 122
| |
* Оксид серы (IV)
– Конец работы –
Используемые теги: Сборник, задач, Чиркст, Литвинова, Черемисина, Дубровская, Иванов, Григорьева0.095
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Сборник задач Д.Э.Чиркст, Т.Е.Литвинова, О.В.Черемисина, Н.Я.Дубровская, И.И.Иванов, Л.В.Григорьева
Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов