рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- СВОЙСТВА ХЛОРНОЙ КИСЛОТЫ.
Реферат Курсовая Конспект
СВОЙСТВА ХЛОРНОЙ КИСЛОТЫ.
СВОЙСТВА ХЛОРНОЙ КИСЛОТЫ. - раздел Химия, Электросинтез хлорной кислоты Хлорная Кислота—Нсlo4—Одна Из Наиболее Сильных Не...
Хлорная кислота—НСLO4—одна из наиболее сильных неорганических кислот. Безводная хлорная кислота представляет собой бесцветную подвижную жидкость плотностью 1768 кг/м3 при 20 °С, сильно дымящую во влажной атмосфере. Вязкость хлорной кислоты при 20 °С равна 0,795 10-3 Па- °С, т. е. меньше вязкости воды.
Безводная хлорная кислота плавится при температуре около —102 °С, кипит с разложением при 110°С. Теплота ее образования из элементов 36,1 кДж/моль, плавления 6,93, испарения 43,6 кДж/моль и теплота разбавления в 800 частях воды 88,5 кДж/моль.
С водой хлорная кислота образует ряд гидратов:
Тпл.,0С Тпл.,0С
| HCLO4 0.25H2O | -73.1 | HCLO4 3H2O | -40.2 |
| HCLO4 H2O | 49.905 | HCLO4 3.5H2O | -45.6 |
| HCLO4 2H2O | -20.65 | HCLO4 4H2O | -57.8 |
| HCLO4 2.5H2O | -32.1 |
Диаграмма плавкости системы вода—хлорная кислота приведена на рис. 1
В табл. 1 приведена плотность водных растворов хлорной кислоты при различной температуре.
Водные растворы хлорной кислоты обладают хорошей электропроводимостью и используются как электролиты для проведения некоторых электрохимических процессов, в частности, для получения хлорной кислоты.
В табл. 2 приведено удельное электрическое сопротивление водных растворов хлорной кислоты при различной температуре.
Температура кипения растворов хлорной кислоты различной концентрации при давлении 2,4 кПа составляет:
| Концентрация НСLO4, масс.% | 94,8 | 92,0 | 84,8 | 79,8 | 70,5 | |
| Температура кипения, °С | 16,0 | 24,8 |
Безводная хлорная кислота весьма реакционно-способна, при соприкосновении со многими легкоокисляющимися органическими веществами она взрывается. Безводная хлорная кислота — сильный окислитель. Элементарный фосфор и сера окисляются хлорной кислотой до фосфорной и серной кислоты. Иод окисляется хлорной кислотой; бром, хлор, а также НВг и НСL не взаимодействуют с нею даже при нагревании.
Таблица 1. Плотность водных растворов хлорной кислоты в интервале от —25 до 75 °С (в г/см3)
| Концентрация, % | Температура, °С | ||||||
| - 25 | |||||||
| — | 1,0637 | 1,0597 | 1,0579 | 1,0539 | 1,0437 | 1,023 | |
| — | 1,1356 | 1,1279 | 1,1252 | 1,2000 | 1,1075 | 1,096 | |
| 1,2312 | 1,2168 | 1,2067 | 1,2033 | 1,1965 | 1,1821 | 1,160 | |
| 1,3308 | 1,3111 | 1,2991 | 1,2947 | 1,2866 | 1,2703 | 1,251 | |
| 1,4528 | 1,4255 | 1,4103 | 1,4049 | 1,3944 | 1,3752 | 1,350 | |
| 1,5908 | 1,5580 | 1,5386 | 1,5327 | 1,5218 | 1,4994 | 1,470 | |
| 1,7306 | 1,6987 | 1,6736 | — | — | 1,6344 | 1,617 | |
| — | — | — | — | — | 1,7540 | 1,727 | |
| — | — | — | — | — | 1,7720 | 1,738 | |
| — | — | — | 1,8043 | — | 1,7515 | 1,704 | |
| — | 1,8077 | — | 1,7676 | —— | 1,7098 | — |
Таблица 2. Удельное электрическое сопротивление водных растворов хлорной кислоты (в Ом-м-102)
| Температура, °С | Концентрация НClO4 масс. % | ||||||
| 2,207 | 1.272 | 1,028 | 1,001 | 1,154 | 1,540 | 2,401 | |
| 2,428 | 1.397 | 1.132 | 1.106 | 1.286 | 1,725 | 2,704 | |
| 2.715 | 1,562 | 1,262 | 1,240 | 1,452 | 1,961 | 3,084 | |
| 3,100 | 1.436 | 1,414 | 1,670 | 2,275 | 3,575 | ||
| 3,628 | 2,072 | 1,665 | 1.647 | 1.964 | 2,705 | 4,227 | |
| 4,420 | 2.488 | 1,992 | 1.968 | 2.376 | 3,320 | 5,129 | |
| —10 | — | 3.102 | 2.464 | 2.436 | 2.982 | 4,242 | 6,418 |
| —20 | — | — | 3,176 | 3.133 | 3.919 | 5,742 | — |
| —30 | — | — | — | 4,250 | 5.505 | 8,402 | 11,59 |
| —40 | — | — | — | 6.21 | 13.82 | — | |
| —50 | — | — | — | 10,41 | — | 27,10 | — |
Хлорная кислота при хранении при комнатной температуре медленно разлагается, что обнаруживается по потемнению жидкости вследствие окрашивания ее продуктами разложения. Такая кислота опасна при хранении, так как может самопроизвольно взрываться. Поэтому обычно безводную хлорную кислоту не хранят, а стараются готовить непосредственно перед ее использованием.
Стабильность хлорной кислоты может быть повышена добавками ингибиторов. В качестве ингибиторов могут служить, в частности, органические соединения, содержащие трихлорметильную группу. Наиболее эффективными ингибиторами являются трихлоруксусная кислота и тетрахлорид углерода.
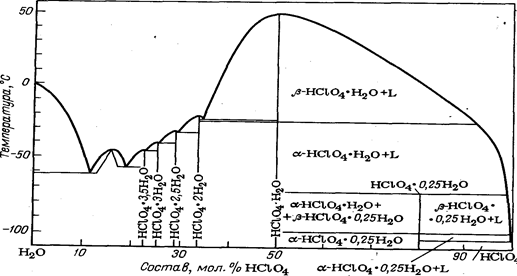
Рис. 1. Диаграмма плавкости системы НСLO4—Н2O.
Все работы, связанные с использованием хлорной кислоты и ее солей, требуют большой осторожности. При наличии примесей в хлорной кислоте возможен самопроизвольный распад кислоты со взрывом.
Попадание хлорной кислоты на кожные покровы приводит к болезненным химическим ожогам.
Хранить и перевозить хлорную кислоту разрешается только в виде водного раствора с концентрацией не более 70% НСLO4. В случае необходимости применения безводной или концентрированной хлорной кислоты, последнюю готовят непосредственно перед использованием. Срок хранения концентрированной кислоты крайне ограничен, особенно при потемнении жидкости из-за окрашивания ее продуктами разложения.
4.ПРОИЗВОДСТВО ХЛОРНОЙ КИСЛОТЫ .РЕАКЦИИ НА ЭЛЕКТРОДАХ И УСЛОВИЯ ЭЛЕКТРОЛИЗА.
При электролизе водных растворов соляной кислоты на аноде возможно выделение элементарного хлора или кислорода, а на электродах с высоким анодным потенциалом — также образование высших кислородных соединений хлора — хлорной кислоты. В зависимости от условий проведения процесса и прежде всего от концентрации ионов С1-, температуры и применяемого анодного материала, скорости этих трех процессов могут очень сильно изменяться.
При электролизе концентрированной соляной кислоты на анодах всех видов, стойких в этих условиях, происходит выделение элементарного хлора с выходом по току, близким к 100%. По мере снижения концентрации соляной кислоты выход хлора по току уменьшается за счет увеличения скорости выделения кислорода на аноде, а при применении графитовых анодов и за счет окисления графита. Образование хлорной кислоты наблюдается только в сильно разбавленных растворах НС1. При электролизе 1 н. раствора на платиновых анодах соляная кислота расходуется практически нацело на получение хлора, а образование хлорной кислоты идет в очень малой степени. При снижении концентрации соляной кислоты до 0,1 н. примерно 50% НС1 расходуется на образование хлорной кислоты и 50% — на получение газообразного хлора.
Окисление ионов хлора до хлорной кислоты протекает при высоком положительном потенциале 2,8—3,0 В. На графитовом аноде в водных растворах хлоридов невозможно достичь такого потенциала, поэтому на этих анодах образование хлорной кислоты не наблюдается даже в сильно разбавленных растворах.
– Конец работы –
Эта тема принадлежит разделу:
Электросинтез хлорной кислоты
На сайте allrefs.net читайте: "Электросинтез хлорной кислоты"
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: СВОЙСТВА ХЛОРНОЙ КИСЛОТЫ.
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов