Теплоты химических реакций и их связь с изменением термодина-мических функций.
4.2.2.1. Теплота при постоянном объеме 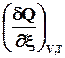
Теплотой химической реакции называют количество тепла, которое выделяется(–) или поглощается(+) за один пробег химической реакции (т.е. при полном превращении реагентов в продукты в мольных количествах, соответствующих стехиометрическим коэффициентам), при постоянном объеме, постоянной температуре и отсутствии полезной работы.
Если W’ = 0, то U = f (T, V, ξ); Qv = DU Þ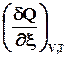 =
= 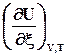 . (2.12)
. (2.12)
4.2.2.2. Теплота при постоянном давлении. 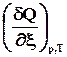
Аналогичные рассуждения приводят к выражению теплоты реакции при постоянном давлении через изменение энтальпии
Qр= DН Þ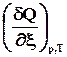 =
=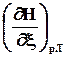 ,при р=const, T=const, W’ = 0, x = 1. (2.13)
,при р=const, T=const, W’ = 0, x = 1. (2.13)