Первое следствие.
4.4.1.1. Понятие стандартной теплоты образования вещества
Согласно 1-ому закону термодинамики невозможно измерить абсолютное значение энергии, а только ее изменение. Поэтому нужно выбрать для различных веществ условный нуль, относительно которого определяются изменения внутренней энергии. За такой уровень отсчета приняты состояния простых веществ при стандартных условиях. Простые вещества образованы из атомов одного элемента. Если элемент существует в нескольких простых формах, то выбирается наиболее устойчивая модификация H2(газ), O2 (газ), N2(газ), Ar(газ) , Cграфит, S(ромб), Br2(ж)
Стандартная теплота образования – это тепловой эффект реакции образования вещества из простых веществ в стандартных состояниях. Обозначается DfH˚ или DfU˚, для простых веществ DfH˚=DfU˚= 0.
Пример,
Cграф. + 1/2 O2 + 3 H2 = C2 H5 OH(жидк.) ; DrH˚= DfH˚
4.4.1.2. Стандартное состояние – наиболее устойчивая форма чистого вещества, для газов – давление 1 атмосфера и газ должен обладать свойствами идеального газа, т.е. для него справедливо уравнение Менделеева-Клапейрона, конденсированные фазы находятся в равновесии со своим паром. Температура не входит в понятие стандартного состояния. Оно возможно при любой температуре. В справочниках теплоты образования приводятся при температуре 298,15 К, но это специально оговаривается DfH˚298.
4.4.1.3. 1-ое следствие из закона Гесса используется для определения теплот химических реакций по справочным данным, т.е. по теплотам образования веществ
0 = 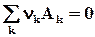 ;
; 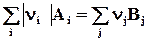 DrH˚-?
DrH˚-?
 DrH˚
DrH˚

 Реагенты Продукты
Реагенты Продукты
 | |||
 | |||



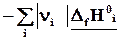 Простые вещества
Простые вещества 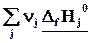
Простые вещества одинаковы для реагентов и продуктов, поэтому
 DrH˚=
DrH˚= 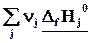
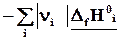 =
= 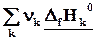 (3.1)
(3.1)
Теплота реакции равна сумме теплот образования конечных веществ минус сумма теплот образования исходных веществ с учетом модуля стехиометрических коэффициентов.