Приближенный расчет теплот химических реакций по знергиям связи
4.5.1. Энергия связи – это средняя энергия, необходимая для разрыва связи в 1 моле газообразного вещества до состояния газообразных атомов:
HClгаз = H + Сl; DrН = εHCl
H2Oгаз = 2 Н + О; DrН = 2 εHCl
H2Oгаз = Н + ОН DrH = 497 кДж/моль
OН = О + Н DrH = 421 кДж/моль
eОН = 918/2 = 459 кДж/моль
Cучетом других реакций принято считатьэнергию связиОНравнойeОН =467кДж/моль. Энергию ковалентных химических связей в слож-ных молекулах в первом приближении можно считать величиной адди-тивной, т.е. энергии связи независимы и всегда положительны, так как разрыв связей – реакция эндотермическая. Поэтому энергия обра-зования газообразного вещества из атомов (DfаH) может быть приближенно оценена как сумма энергий связи с обратным знаком
DfаH = -DHатомизации = - Σ nрεр(3.5)
4.5.2. Расчет стандартной теплоты образования вещества по энергиям связи.Составим цикл: проведем атомизацию простых веществ, затратив энергию 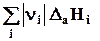 , образуем из атомов заданное газообразное вещество и переведем его в стандартное состояние, при этом выделится теплота испарения DvH., если стандартное состояние жидкое, и теплота плавления DmH, если вещество твердое.
, образуем из атомов заданное газообразное вещество и переведем его в стандартное состояние, при этом выделится теплота испарения DvH., если стандартное состояние жидкое, и теплота плавления DmH, если вещество твердое.
3 Сграф. + 3 Н2 + 1/2О2 = Н3С-СО-СН3 ж ; DfH˚-?


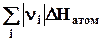 - DvH
- DvH
3 Сгаз. + 6 Н + О = Н3С-СО-СН3 газ ; DfаH = - Σ nрεр.
DfH˚= 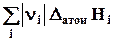 – S npep – DvH. (3.6)
– S npep – DvH. (3.6)
4.6. Цикл Габера-Борна описывает процессы, вносящие вклад в образо-вание ионных кристаллических соединений. Рассмотрим их на примере образования хлорида натрия
Naтв.+ ½ Cl2(газ) = NaClтв. ; DrН = DfHo
Na+ газ + Сl газ + е-


Есродства Cl = -354
Na+ газ + Сl ¯газ

 Потенциал ионизации
Потенциал ионизации
 Na газ + СlI = 502
Na газ + СlI = 502

Na газ + ½ Сl2 ½ DHдисс.=121

 Eрещетки= 788
Eрещетки= 788
Naтв. + ½ Cl2газ DHcублим. Na=108 DHгидр.Na+ +

 + DHгидр.Cl¯
+ DHгидр.Cl¯
DfHo = - 411
NaClтв
 |
Na+ aq + Сl -aqDHm

DfHo = DHсубл. Na + ½ DHдисс Сl2 + INa + Есродствa Cl - Eрещетки = (3.7)
= 108 + 121 + 502 – 354 – 788 = 411 кДж/моль