Теплоемкость твердых тел
В твердом теле единственным видом движения является колебания элементов кристаллической решетки, ячейки которой повторяются в пространстве. Твердое тело (например, металл) можно представить как набор гармонических осцилляторов, колеблющихся с одинаковой частотой n. Исследуя такую модель, Эйнштейн вывел теоретическую формулу для расчета теплоемкости твердого тела на основании статистической термодинамики
Сv = 3R (q/T)2 e q/T ,где(4.6)
 (e q/T –1)2
(e q/T –1)2
где q = hn/kназывается характеристической температурой.
При низкой температуре q/T → µ, a теплоемкость → 0
При высокой температуре q/T → 0, a теплоемкость → 3R
Закон Дюлонга и Пти для простых веществ:
Сv = суд.М =6,3 кал/моль.К, где М - атомная масса элемента (4.7)
При очень низких температурах вблизи абс. нуля справедлив закон Дебая:
Сv = а Т3 (4.8)
4.8.3. Представление температурной зависимости теплоемкости в виде температурного ряда. Так как теоретических общих уравнений для зависимости теплоемкости от температуры нельзя вывести, то используются экспериментальные зависимости в виде степенного ряда
для органических веществ Ср = а + bТ + сТ2 + dT3; (4.9)
для неорганических веществ Ср = а + bТ + с' Т-2. (4.10)
4.8.4. Уравнение Кирхгоффа – зависимость теплоты реакции от температуры
Используя уравнения связи теплот химических реакций с изменением термодинамических функций легко вывести зависимость их от температуры
QV = DrU = 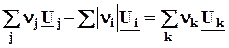 , (2.14,2.15)
, (2.14,2.15)
Qp = DrH = 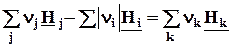 . (2.16)
. (2.16)
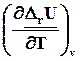 =
= 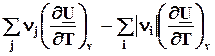 =
= 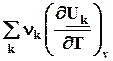 =
= 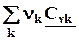 = DrСv, (4.11)
= DrСv, (4.11)
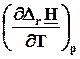 =
= 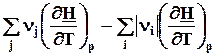 =
= 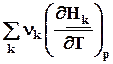 =
= 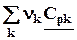 = DrСp. (4.12)
= DrСp. (4.12)
DrСp. = Dа + DbT + DcT2 + Dd T3 + Dc'T-2. (4.13)