Для каждой фазы a, содержащей k компонентов, существует аддитивная функция состояния, называемая энтропией
Sa = Sa(Ua, Va, n1a, na2 , ..nak); 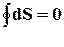 , S =
, S = 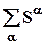 , DS = S2 – S1
, DS = S2 – S1
 изменение которой следующим образом связано с теплотой и температурой процессар
изменение которой следующим образом связано с теплотой и температурой процессар
 dS =
dS = 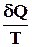
 для обратимых процессов; (5.1) p1 V1 T1 S1
для обратимых процессов; (5.1) p1 V1 T1 S1
 dS >
dS > 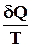 для необратимых процессов. (5.2) p2V2 T2 S2
для необратимых процессов. (5.2) p2V2 T2 S2
(Неравенство Клаузиуса) V
Рис. 5.1. К понятию энтропии.
Температура – интегрирующий делитель, который превратил функцию процесса в изменение функции состояния, а энтропия – тепловая координата.
Работу всегда можно выразить как произведение интенсивного параметра на изменение экстенсивного
dW= - 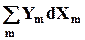 , (5.3),
, (5.3),
а теплоту – аналогично dQ = TdS –для обратимых процессов, (5.4)
где Т – интенсивный параметр, а dS изменение экстенсивного свойства.
Объединяя 1 и 2 законы термодинамики (уравнения 2.2 и 5.1), получаем
d U = TdS – pdV + 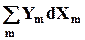 . (5.5)
. (5.5)
5.2.5. Анализ уравнений типа (5.5) привел Каратеодори к новой формулировке 2-го закона термодинамики, не связанной с тепловыми машинами:
вблизи любого состояния термически однородной и адиабатически изолированной системы есть бесконечное множество других состояний, не достижимых адиабатическим путем. В этом случае Т становится интегрирующим делителем, а S – функцией состояния.
5.3 Расчет изменения энтропии в различных процессах.
Изменение энтропии нельзя непосредственно измерить, измерять можно только теплоту. Количество теплоты может быть различным в обратимом и необратимом процессе, но изменение энтропии в них должно быть одинаковым, если одинаковы начальное и конечное состояния
dSобр. = 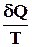 обр.
обр.

S2 – S1 = dSнеобр. > 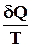 необр Þ
необр Þ 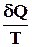 обр.
обр. >
> 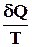 необр. (5.6)
необр. (5.6)
Как и работа, теплота обратимого процесса всегда больше теплоты необ-ратимого при заданных начальном и конечном состояниях.