Критерии направления самопроизвольных процессах в изотермических условиях. Термодинамические потенциалы.
Фундаментальные уравнения Гиббса определяют свойства термодинамических систем, когда в качестве независимых переменныых выступают экстенсивные параметры (U, VилиS, V),которые нельзя непосредственно контролировать.Это делает их неудобными для их практического использования. В связи с этим требуется преобразовать эти уравнения таким образом, чтобы независимыми параметрами стали бы контролируемые величины, удобнее всего интенсивные (именно в этих условиях обычно проводятся химические реакции) при сохранении характеристичности функций.
7.2.1. Энергия Гельмгольца.
7.2.1.1. Физический смысл
Преобразуем выражение (7.6) таким образом, чтобы функции состояния попали в одну сторону неравенства – влево:
dU - TdS £ -dW.
Представим изотермический процесс и проинтегрируем это уравнение
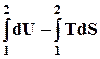 £ -WT Þ DU - TDS £ -WT Þ U2 – U1 – T(S2 – S1) £ -WT.
£ -WT Þ DU - TDS £ -WT Þ U2 – U1 – T(S2 – S1) £ -WT.
(U2 –TS2) – (U1 –TS1) = DA £ - WT. (7.8)
Получили новую функцию состояния, называемую энергией Гальмгольца
A º U – TS(7.9)
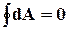 ; DA = A2 – A1.
; DA = A2 – A1.
DA £ -WT; -DA ³ WT; -DA= (WT)max (7.10)
Убыль энергии Гельмгольца равна максимальной работе обратимого изотермического процесса. В необратимом процессе работа полученная оказывается меньше убыли энергии Гельмгольца, а затраченная забота больше роста энергии Гельмгольца.
7.2.1.2. Направление самопроизвольных процессов при Т,V = const.
Напишем полный дифференциал энергии Гельмгольца и подставим в него фундаментальное уравнение Гиббса (7.6)
dA = dU – TdS – SdT Þ dA £ TdS - pdV - dW’ – TdS – SdT
dA £ - SdT - pdV - dW’ .
При Т,V = const в самопроизвольном процессе dW’³0, отсюда критерием на-
правления самопроизвольного процесса будет уменьшение энергии Гельмгольца
dA V,T £ 0при Т,V = const(7.11)
Стабильное равновесие достигается при минимуме энергии Гельмгольца.
dA V,T = 0; (d2A/d Х2) V,T > 0 (7.12)
– условие стабильного равновесия при Т,V = const.
7.2.1.3. Полный дифференциал энергии Гельмгольца в зaкрытой системе
dA = – SdT – pdV(7.13)
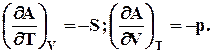 (7.14)
(7.14)
С ростом температуры и объема энергия Гельмгольца всегда падает, так как энтропия и давление системы всегда имеют положительное значение, и производные будут отрицательными.
7.2.2. Энергия Гиббса.