Влияние давления на направление реакции
Уравнение изотермы химической реакции позволяет определить, как изменяется направление реакции, если мы изменяем общее давление в системе
3/2 H2 + 1/2N2 = NH3 T = 500 K DrG˚500 = 9.26 кДж.
Стандартное изменение энергии Гиббса положительно, т.е. при стандартных условиях реакция не идет в прямом направлении. Если сильно повысить давление до 600 атм, т.е. парциальное давление каждого газа будет cоставлять 200 атм, то знак DrG изменится
DrG = DrG˚ + RT ln
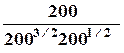 = 9260 - 8.314*500 ln 5.29 = -12600 Дж.
= 9260 - 8.314*500 ln 5.29 = -12600 Дж.
Соотношение между веществами осталось то же, но увеличение давления изменило направление реакции, так как в ней уменьшается число молей газообразных веществ Dnгаз = -1.В связи с этимхимическое сродствоэтой реакции возрастает с ростом общего дваления в системе при неизменном относительном составе.