Константа равновесия
DGpT = DGT0+ RT lnP p*knk = DGT0 + RT ln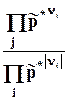 = 0. (9.9)
= 0. (9.9)
В состоянии равновесия при p,T = const DGpT = 0.Так как стандартное изменение энергии Гиббса зависит только от температуры, то и второе слагаемое в уравнении (9.10) также является функцией только температуры
- DGT0 = RT lnP p*knk = f (T) (9. 10)
Отношение равновесных парциальных давлений продуктов к давлению реагентов в степенях, соответствующих модулю стехиометрических коэффициентов, является величиной постоянной при Т=const и называется константой равновесия.
Kp = 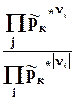 = P p*knk = f(T)и(9.11)
= P p*knk = f(T)и(9.11)
- DrGT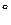 = RT ln Kp(9.12)
= RT ln Kp(9.12)
Мы пришли к важнейшему выводу: константа равновесия однозначно определяется стандартным изменением энергии Гиббса в химической реакции, а уравнение изотермы можно представить в новом варианте
DrGpТ = RT ln k/Kp, (9.13)
где k- отношение произвольных парциальных давлений продуктов и реа-гентов.
Для гетерогенных реакций в константу равновесия входят только равновесные парциальные давления газообразных веществ. Константа равновесия величина безразмерная, так как давления должны быть приведены к выбранному стандартному давлению. Таким образом мы получили термодинамический вывод закона действующих масс.