Использование уравнения Вант-Гоффа
9.4.3.1. Определение DrHº по температурной зависимости константы равновесия
а) две точки в небольшом интервале температур, DrHº= сonst
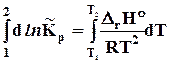 =
= 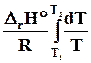

ln 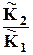 =
= 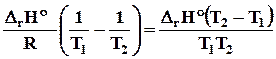 Þ
Þ

DrHº = R
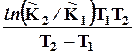 . (10.3)
. (10.3)
b) много точек в небольшом интервале температур (DrHº= const).
ln Kp = - DrHº/R T + C(10.4)
Нужно построить график в координатах ln Kp = f (1/T)
 ln Kp
ln Kp
 DrHº < 0 tg a = - DrHº / R
DrHº < 0 tg a = - DrHº / R
DrHº > 0
 |
Рис. 10.1. Зависимость логарифма константы равновесия от 1/T
В большом интервале температур зависимости могут быть криволинейными,
тогда нужно брать тангенс наклона касательной.
9.4.3.2. Определение константы равновесия при изменении температурыИзвестна константа равновесия при Т1 и DrHº,требуется найти константу при другой температуре
a) малый интервал темпратур DrH 0 = const,из уравнения (10.3)
lnK2 – lnK 1 = 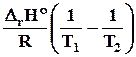 .Откуда
.Откуда
lnK2 = lnK1 +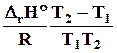 . (10.5)
. (10.5)
b) большой интервал температур DrHº= f (T). В дифференциальное уравнение Вант-Гоффа (10.1) нужно подставить DrHº = f (T) (4.19) и проинтегрировать
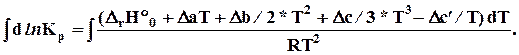
lnKp = - DrHº0 /RT + Da/R* ln T + Db/2R* T + Dc/6R*T2 + Dc’/2RT2 + const (10.6)
Зная константу равновесия при какой-либо температуре, можно найти постоянную интегрирования, а затем рассчитывать константу при любой температуре.
9.5. Расчетные и экспериментальные методы определения DrG0 и констант равновесия
9.5.1. По справочным данным о стандартной энергии Гиббса для реакции образования веществ DfGº. Так как нельзя определить абсолютное значение внутренней энергии, этого нельзя сделать и для энергии Гиббса, поэтому за уровень отсчета принимают стандартные состояния простых веществ, для которых энергию Гиббса полагают равной 0. В справочниках приводятся данные по энергиям Гиббса, отсчитанным от этого уровня. Тогда
DrGº = SjnjDfGºj - Si ên êiDfGºi = SknkDfGºk (10.7)
9.5.2. Если нет данных по DfGº, то можно использовать справочные данные по стандартным теплотам образования и абсолютным энтропиям веществ
DrGº = DrHº – T DrSº,(10.8)
где DrHº = SjnjDfHºj - Si ên êiDfHºi = SknkDfHºk
и DrSº = SjnjSºj - Si ên êiSºi = SknkSºk.
Эти уравнения показывают, что самопроизвольному протеканию реакции
(DrGº<0) способствует ее экзотермичность (DrHº<0) и рост энтропии, однако обычно, если DrHº<0, то DrSº<0 также, т.е. энергетический и энтропийный факторы действуют в разных направлениях, причем роль энтропийного фактора возрастает с повышением температуры:
DrHº<0иDrSº<0 Þ при çDrHºç> TDrSº, тогда DrGº<0; lnK > 0; K > 1;
при çDrHºç< TDrSº, тогда DrGº>0 ; lnK < 0; K < 1.