Экспериментальное определение констант равновесия.
-DrGºT = RT ln Kp. Положительное значение DrGºTне означает, что реакция вообще не может идти, она не может протекать в стандартных условиях, когда реагенты и продукты присутствуют в системе под давлением 1 атм. Но в отсутствии продуктов в начале реакции, реакция, конечно, пойдет до состояния равновесия и задача экспериментатора найти равновесную степень превращения, равновесный выход или состав равновесной смеси при заданных исходных условиях. Каждая реакция требует своего подхода для определения этого равновесного состояния системы, но в любом случае нужно составить материальный баланс реакции и выразить изменение какой-либо измеряемой величины через химическую переменную. Для газовых реакций в которых изменяется число молей газообразных веществ, такой измеряемой величиной может быть реакционный объем при постоянном давлении. Разберем это на примере реакции
NO2 = NO + 1/2O2 .Если nk0 = 1, то x = a
nk -1 1 1/2
nk0 1 0 0
nk* 1 - x* = a* 1/2a*
=1 - a*, Σnk* =1+1/2a*
Nk* 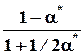
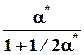
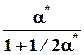
pk* p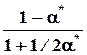 p
p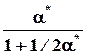 p
p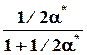
где nk0и nk* - начальные и равновесные числа молей веществ, Nk*- равно-весные мольные доли, а pk* – равновесные парциальные давления веществ,
pk* = p.Nk* = p nk*/S nk* , р –общее давление в системе.
Кр= 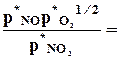
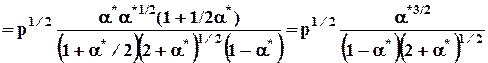 . (10.9)
. (10.9)
V*/V0 = n*/n0 = (1 + 1/2a*) ; (V*- V0)/V0 = 1/2a*.
Измеряя относительное увеличение объема, можно найти равновесную степень превращения и константу равновесия, и, наоборот, зная констан-ту, легко найти равновесный выход в любых условиях.
9.5.5. По известным константам равновесия некоторых реакций, можно найти константу равновесия для любой линейной комбинации этих реакций.
FeO + C = Fe + CO K = ?
 1 FeO + CO = Fe + CO2 K1 DrG1º
1 FeO + CO = Fe + CO2 K1 DrG1º
1/2 2 C + O2 = 2 CO K2 DrG2º
-1 CO + 1/2 O2 = CO2 K3 DrG3º
DrGº = DrG1º + 1/2DrG2º - DrG3º;
ln K = ln K1 + ½1/2lnK2 – ln K3;K = K1 K21/2 K3-1.
Константа равновесия реакции равна произведению констант равновесия реакций в степенях соответствующих коэффициентам, с которыми эти реакции входят в линейную комбинацию, составляющую данную.
9.5.6. Приведенный потенциал Энтальпия и энтропия химической реакции слабо зависят от температуры, а энергия Гиббса – сильно, так как включает член T DrSº. Поэтому в справочниках можно найти для разных веществ так называемый приведенный потенциал
Ф(Т) = (GºТ – Hº0)/T, (10.10)
который изменяется с ростом температуры значительно медленнее, а значения Т даются с интервалом в 100º. В формуле 10.10 Hº0 – теплота реакции образования при абсолютном нуле, которая также приводится в таблицах приведенных потенциалов веществ .
Отсюда для каждого вещества Gº/T = Ф(Т) + Hº0/T,иприменяя оператор Dr, находим
lnKp = -Dr GºТ/RT = –1/R [Dr Ф (Т) + Dr Hº0/T ].(10.11)
Таким образом, для расчета константы при равновесия при любой таблич-ной температуре Тнужно найти в справочнике две термодинамические характеристики для компонентов системы Ф(Т) + Hº0. Для уточнения констант при любой температуре можно воспользоваться уравнением Вант-Гоффа, определив теплоту реакции в заданном интервале по табличным значениям разности теплот образования при температуре Т и абсолютном нуле (HТ –H0), приводяшейся в этих же таблицах.
Dr НºТ = Dr Нº0 + Dr (HТ –H0).(10.12)