Изохорное нагревание
dQv = n CvdT = dUv ê: n Þ dUV = CvdT Þ Cv = 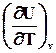 ,(2.4)
,(2.4)
где Cv – мольная теплоемкость системы при постоянном объеме.
Cv – мольная теплоемкость системы при постоянном объеме.
dQ = m cуд dT
3.2.3. Изобарный процесс p = const
3.2.3.1. Работа изобарного процесса
dW = 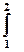 pdV = p (V 2 – V 1) = p D V(2.5)
pdV = p (V 2 – V 1) = p D V(2.5)
3.2.3.2. Теплота изобарного процесса
Qp = DU + p D V = ( U2 + pV2 ) – (U1 + pV1) = H2 – H1 = D H
Qp = DH.(2.6)
Функция, стоящая в скобках называется энтальпией. Таким образом, можно сделать вывод: в отсутствие полезной работы теплота изобарного процесса равна изменению энтальпии
3.2.3.3. Энтальпия – функция состояния
Н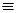 U + pV(2.7)
U + pV(2.7)
В энтальпию входит внутренняя энергия (функция состояния) и произведение параметров, поэтому она также представляет собой функцию состояния, т.е. ее изменение не зависит от пути процесса.
Полный дифференциал энтальпии dH = dU + pdV + Vdp.
При р = const dH = dU + pdV =dQp.