Константы нестойкости
Если вместо равновесия в реакциях образования комплексов рассматривать обратный процесс – реакции диссоциации комплексов (или реакции обмена лигандов на молекулы растворителя), то соответствующие константы будут носить название ступенчатых констант нестойкости комплексов:
[ML] 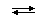 M + L; K1(нест) = [M] ´ [L] / [ML]
M + L; K1(нест) = [M] ´ [L] / [ML]
[ML2] 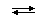 [ML] + L ; K2(нест) = [ML] ´ [L] / [ML2]
[ML] + L ; K2(нест) = [ML] ´ [L] / [ML2]
…….
[MLn] 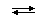 [ML(n-1)] + L; Kn(нест) = [ML(n-1)] ´ [L] / [MLn];
[ML(n-1)] + L; Kn(нест) = [ML(n-1)] ´ [L] / [MLn];
и общих (суммарных) констант нестойкости комплексов:
[ML] 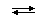 M + L; b1(нест) = [M] ´ [L] / [ML]
M + L; b1(нест) = [M] ´ [L] / [ML]
[ML2] 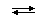 M + 2 L; b2(нест) = [M] ´ [L]2 / [ML2]
M + 2 L; b2(нест) = [M] ´ [L]2 / [ML2]
[ML3] 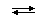 M + 3 L; b3(нест) = [M] ´ [L]3 / [ML3]
M + 3 L; b3(нест) = [M] ´ [L]3 / [ML3]
…….
[MLn] 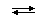 M + n L; bn(нест) = [M] ´ [L]n / [MLn]
M + n L; bn(нест) = [M] ´ [L]n / [MLn]
Ступенчатые и общие константы образования и нестойкости комплексов соотносятся друг с другом как обратные величины:
bn(обр) = 1 / b n(нест); Kn(обр) = 1 / Kn(нест),
поэтому для сравнения прочности комплексов могут использоваться справочные данные как по значениям констант образования, так и констант нестойкости.
Ступенчатое комплексообразование можно проиллюстрировать примером взаимодействия иона Hg2+ (как комплексообразователя) с ионами Cl- (как лигандом):
Hg2+ + Cl- 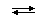 [HgCl]+; K1(обр) = 1,85 . 105
[HgCl]+; K1(обр) = 1,85 . 105
[HgCl]+ + Cl-  [HgCl2]; K2(обр) = 3,2 . 107
[HgCl2]; K2(обр) = 3,2 . 107
[HgCl2] + Cl-  [HgCl3]- ; K3(обр) = 14
[HgCl3]- ; K3(обр) = 14
[HgCl3]- + Cl-  [HgCl4]2- ; K4(обр) = 10
[HgCl4]2- ; K4(обр) = 10
Чем больше концентрация хлоридных ионов, тем с большим координационным числом образуется комплексное соединение. Как только будет достигнуто максимально возможное для данного комплексообразователя координационное число, образование новых комплексных соединений приостанавливается, и при дальнейшем увеличении концентрации лиганда наблюдается постепенное исчезновение в растворе комплексных частиц с меньшими координационными числами.
Из рис. 2 видно, что уже при концентрации хлорид-ионов, равной 1 . 10-5 моль/л, в растворе полностью исчезают катионы Hg2+ и образуются преимущественно нейтральные частицы [HgCl2]. При концентрации хлорид-ионов около 0,1 моль/л в растворе присутствуют комплексы [HgCl2], [HgCl3]- и [HgCl4]2- . 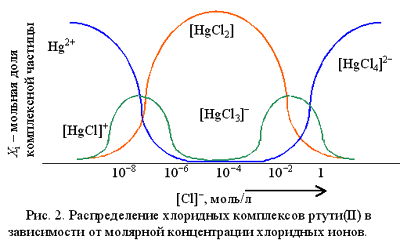
При концентрации ионов Cl- свыше 1 моль/л в растворе присутствуют только тетрахлоромеркурат(II)-ионы [HgCl4]2- , которые довольно легко диссоциируют, отщепляя хлоридный лиганд, но обладают достаточно высокой полной константой образования:
b4(обр) = K1(обр) ´ K2(обр) ´ K3(обр) ´ K4(обр) =
= (1,85 . 105) ´ (3,2 . 107) ´14 ´10 = 8,3 . 1014
Таким образом, полная константа образования дает возможность судить об отсутствии склонности комплекса к полной диссоциации, а ступенчатая константа образования свидетельствует об устойчивости отдельных форм комплексных ионов или нейтральных комплексов.
Как правило, ступенчатые константы образования уменьшаются по мере возрастания числа лигандов. Например, взаимодействие такого комплексообразователя, как ион Cd2+, с молекулами аммиака, выполняющими функции лиганда, протекает поэтапно, с постепенным уменьшением значения ступенчатой константы образования:
Cd2+ + NH3  [Cd(NH3)]2+ ; K1(обр) = 450
[Cd(NH3)]2+ ; K1(обр) = 450
[Cd(NH3)]2+ + NH3  [Cd(NH3)2]2+ ; K2(обр) = 126
[Cd(NH3)2]2+ ; K2(обр) = 126
[Cd(NH3)2]2+ + NH3  [Cd(NH3)3]2+ ; K3(обр) = 27,5
[Cd(NH3)3]2+ ; K3(обр) = 27,5
[Cd(NH3)3]2+ + NH3  [Cd(NH3)4]2+ ; K4(обр) = 8,5
[Cd(NH3)4]2+ ; K4(обр) = 8,5
[Cd(NH3)4]2+ + NH3 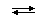 [Cd(NH3)5]2+ ; K5(обр) = 0,47
[Cd(NH3)5]2+ ; K5(обр) = 0,47
[Cd(NH3)5]2+ + NH3 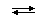 [Cd(NH3)6]2+ ; K6(обр) = 0,02
[Cd(NH3)6]2+ ; K6(обр) = 0,02
Однако бывают и исключения, например, уже указанные выше хлоридные комплексы ртути(II).
Среди причин закономерного уменьшения значений ступенчатых констант образования с увеличением числа лигандов прежде всего выделяют возрастание пространственных затруднений в размещении вокруг комплексообразователя все большего числа лигандов и электростатическое отталкивание одноименно заряженных лигандов.