рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Комплексные соединения
Реферат Курсовая Конспект
Комплексные соединения
Комплексные соединения - раздел Химия, Введение Комплексные Ионы Комплексные Соединения Р...
Введение
Комплексные ионы
Комплексные соединения
Реакции комплексообразования
Координационные соединения
В различных реакциях, протекающих в растворе, мы обнаруживаем участие неизменных группировок атомов, выступающих либо в виде ионов (SO42- , OH-, NO2-, CO32-, NO2+ и т.д.), либо в виде нейтральных молекул (NH3, CO, NO и других). Эти неизменные группировки атомов способны к взаимодействию в растворе с ионами металлов или нейтральными молекулами с образованием более сложных частиц. Например, ион Cu2+ взаимодействует в растворе с молекулами NH3 по обратимой реакции с образованием сложного катиона:
Cu2+ + 4 NH3  [Cu(NH3)4]2+
[Cu(NH3)4]2+
а ион Fe2+ легко присоединяет ионы CN-, образуя сложный анион:
Fe2+ + 6 CN-  [Fe(CN)6]4-
[Fe(CN)6]4-
Молекула SnCl4 может присоединить два иона Cl- и образовать сложный анион:
SnCl4 + 2 Cl-  [SnCl6]2-
[SnCl6]2-
Две молекулы BF3 и NH3 могут взаимодействовать с образованием более сложной частицы:
BF3 + NH3  [B(NH3)F3]0
[B(NH3)F3]0
Можно привести множество других примеров подобного рода. Во всех случаях знак обратимости подчеркивает, что образование сложных частиц (ионов и молекул) не протекает до конца, в растворе всегда можно найти не только продукты реакции, но и исходные ионы и молекулы.
Образовавшиеся новые соединения приобретают новые свойства, отличные от свойств составляющих их простых соединений – например, совершенно иную окраску, растворимость и способность взаимодействовать с различными реагентами. Так, иодид ртути(II) взаимодействует в растворе с нитратом серебра с образованием малорастворимого иодида серебра:
HgI2 + 2 AgNO3 = 2 AgI¯ + Hg(NO3)2
После образования сложного соединения с иодидом калия по реакции
HgI2 + 2 KI = K2[HgI4]
свойства иодида ртути(II) как индивидуального вещества исчезают. Продукт состава K2[HgI4] обладает другими химическими свойствами, поскольку образовавшийся сложный анион [HgI4]2- ведет себя в обменных реакциях как неразрывное целое:
K2[HgI4] + 2 AgNO3 = Ag2[HgI4]¯ + 2 KNO3
Подобные сложные образования получили название комплексных ионов или молекул.
Таким образом, комплексным соединением называют сложное соединение, образующееся при взаимодействии более простых неизменных частиц (атомов, ионов или молекул), каждая из которых способна существовать независимо в обычных условиях.
Реакции, в результате которых образуются комплексные соединения, носят название реакций комплексообразования. Пример реакции комплексообразования – взаимодействие SnCl4 и Cl- с получением сложного комплексного аниона [SnCl6]2- :
SnCl4 + 2 Cl-  [SnCl6]2-
[SnCl6]2-
В то же время, например, перхлорат-анион ClO4- не является комплексным, поскольку простые неизменные группировки атомов, на которые он мог бы диссоциировать в обычных условиях, неизвестны.
Комплексные ионы образуют с ионами противоположного заряда комплексные соединения. Так, комплексный ион [Fe(CN)6]3- образует с ионами K+ комплексное соединение K3[Fe(CN)6], которое выделяется из водного раствора при его выпаривании в виде кристаллов красного цвета, хорошо растворимых в воде.
Комплексный катион [Cu(NH3)4]2+ образует с анионами SO42- комплексное соединение [Cu(NH3)4]SO4 . 2 H2O, выделяющееся из раствора в виде темно-синих кристаллов, легко разлагающихся на воздухе и при небольшом нагревании.
В дальнейшем комплексными соединениями, или просто комплексами, мы будем называть и комплексные ионы, и комплексные молекулы.
Комплексные соединения называют часто координационными соединениями, подчеркивая тем самым способность простых неизменных частиц определенным образом располагаться (координироваться) друг около друга в комплексном ионе или комплексной молекуле.
Химия комплексных соединений является частью неорганической химии. Она охватывает как чисто неорганические комплексы, так и комплексные соединения, включающие частицы органической природы.
Природу химических связей в комплексах, их строение и принципы их образования объясняет координационная теория.
Глава 1. Основные понятия координационной теории
1.1. Комплексообразователь
1.2. Лиганды
1.3. Дентатность
1.4. Координационное число
1.5. Внутренняя и внешняя сфера
1.6. Многоядерные комплексы
Основы современной координационной теории были изложены в конце прошлого века швейцарским химиком Альфредом Вернером, обобщившим в единую систему весь накопившийся к тому времени экспериментальный материал по комплексным соединениям. Им были введены понятия о центральном атоме (комплексообразователь) и его координационном числе, внутренней и внешней сфере комплексного соединения, изомерии комплексных соединений, предприняты попытки объяснения природы химической связи в комплексах.
Все основные положения координационной теории Вернера используются и в настоящее время. Исключение составляет его учение о природе химической связи, которое представляет сейчас лишь исторический интерес.
Комплексообразователь
M + n L [MLn] где M – нейтральный атом, положительно или отрицательно заряженный условный… В комплексных ионах [Cu(NH3)4]2+, [SiF6]2- , [Fe(CN)6]4- , [BF4]- комплексообразователями являются медь(II),…Лиганды
Лиганды, как правило, не связаны друг с другом, и между ними действуют силы отталкивания. В отдельных случаях наблюдается межмолекулярное… Лигандами могут быть различные неорганические и органические ионы и молекулы.…Дентатность лиганда
Некоторые распространенные лиганды типа молекул воды H2O, гидроксид-иона OH-, тиоцианат-иона NCS-, амид-иона NH2-, монооксида углерода CO в… Существует целый ряд лигандов, которые в комплексах являются практически… Например, в комплексном соединении [Co(NH3)4CO3]NO3 бидентатный лиганд – ион CO32-- образует две связи с…Координационное число
Когда комплексообразователь координирует монодентатные лиганды, то координационное число равно числу присоединяемых лигандов. А число присоединяемых… Значение координационного числа комплексообразователя зависит от его природы,… Между значениями координационного числа и степенью окисления элемента-комплексообразователя существует определенная…Внутренняя и внешняя сфера комплексного соединения
Ионы, нейтрализующие заряд внутренней сферы, но не связанные с комплексообразователем ковалентно, образуют внешнюю сферу комплексного соединения. … Внешнесферные ионы Cl- находятся на более значительном удалении от комплексообразователя, чем молекулы NH3, иначе…Многоядерные комплексы
Атомы комплексообразователя могут быть связаны между собой с помощью мостиковых лигандов, функции которых выполняют ионы OH-, Cl-, NH2-, O22-,… В роли мостикового лиганда может выступать полидентатный лиганд, имеющий… В том случае, когда атомы комплексообразователя связаны между собой непосредственно, многоядерный комплекс относят к…Глава 3. Строение комплексных соединений
3.1. Координационное число 2
3.2. Координационное число 3
3.3. Координационное число 4
3.4. Координационное число 5
3.5. Координационное число 6 и выше
Между координационным числом и строением комплексных соединений (геометрией внутренней координационной сферы) наблюдается определенная закономерность. Ниже рассматриваются некоторые примеры такой закономерности.
Координационное число 2
Координационное число 3
Достоверным примером тройной координации является ион [HgI3]- : Другой вариант расположения лигандов во внутренней координационной сфере при… Пример такого комплекса – ион [SnCl3]- :Координационное число 4
Во-вторых, возможно плоскоквадратное расположение лигандов вокруг находящегося… Большинство комплексных соединений, имеющих координационное число 4, построено тетраэдрически. Такая геометрия…Координационное число 5
Координационное число 6 и выше
Октаэдрическим строением обладают ионы [PtCl6]2-, [Fe(CN)]6]3-, [Al(H2O)2(OH)4]-, [SnCl6]2-, [Co(NO2)6]3- и многие другие. Октаэдрическое строение… Геометрия комплексов с КЧ 7 отвечает пентагональной…Глава 5. Устойчивость комплексных соединений в растворе
5.1. Комплексные соединения без внешней сферы
5.2. Отщепление ионов внешней сферы
5.3. Обратимая диссоциация комплексов
5.4. Ступенчатая и полная константы образования
5.5. Константы образования и прочность комплексов
5.6. Константы нестойкости
5.7. Примеры образования и разрушения комплексов
В растворах комплексных соединений могут происходить разнообразные сложные превращения, определяемые природой как самого комплексного соединения, так и растворителя.
Это, во-первых, диссоциация на комплексные и внешнесферные ионы, затем – диссоциация комплексного иона или нейтрального комплекса, сопровождаемая замещением лиганда во внутренней сфере на молекулы растворителя.
Кроме того, комплексы могут участвовать в разнообразных окислительно-восстановительных процессах, если в состав комплексного иона или растворителя входят ионы или молекулы с ярко выраженными окислительными или восстановительными свойствами.
Комплексные соединения без внешней сферы
Комплексные соединения можно условно разделить на две большие группы: электролиты и неэлектролиты. К неэлектролитам относят прежде всего внутрикомплексные соединения (или хелаты), затем – карбонилы металлов и p-комплексы и некоторые другие.
Растворимые комплексные соединения, не имеющие внешней сферы, ведут себя в растворах как слабые электролиты.
Отщепление ионов внешней сферы
[Cu(NH3)4]SO4 = [Cu(NH3)4]2+ + SO42- K3[Fe(CN)6] = 3 K+ + [Fe(CN)6]3- Если во внешней сфере комплексного соединения находятся гидроксид-ионы, то это соединение – сильное основание…Обратимая диссоциация комплексов
[MLn] M + n L Такая диссоциация, разумеется, протекает ступенчато: лиганды удаляются из… Для упрощения записи в качестве примера взят незаряженный комплекс, а продукт диссоциации представлен в…Ступенчатая и полная константы образования
M + L [ML]; K1(обр) = [ML] / {[M] ´ [L]} [ML] + L [ML2]; K2(обр) = [ML2] / {[ML] ´ [L]} Для n-ой ступени комплексообразования ступенчатая константа образования Kn равна:Константы образования и прочность комплексов
(1) Ag+ + 2 NH3 [Ag(NH3)2]+; b 2(обр) = 2,5 . 106 (2) Ag+ + 2 CN- [Ag(CN)2]-; b2(обр) = 1,2 . 1021 сделаем очевидный вывод о большей прочности второго комплекса – аниона [Ag(CN)2]- , поскольку, судя по большему…Константы нестойкости
[ML] M + L; K1(нест) = [M] ´ [L] / [ML] [ML2] [ML] + L ; K2(нест) = [ML] ´ [L] / [ML2] …….Примеры образования и разрушения комплексов
Рассмотрим некоторые примеры образования и разрушения комплексных соединений в растворе.
· При растворении фторида калия в желтом растворе FeCl3 наблюдается обесцвечивание последнего вследствие образования очень прочного гексафтороферратного аниона:
[Fe(H2O)6]3+ + 6 F-  [FeF6]3- + 6H2O
[FeF6]3- + 6H2O
В этой реакции комплексообразования происходит замещение в комплексных аквакатионах слабо связанных с комплексообразователем молекул воды на фторид-ионы с образованием очень устойчивого комплексного аниона.
· При добавлении водного раствора аммиака к белому осадку хлорида серебра(I) образуется бесцветный устойчивый ион диамминсеребра(I), при этом осадок AgCl растворяется:
AgCl(т) + 2 NH3 . H2O  [Ag(NH3)2]+ + Cl- + 2 H2O
[Ag(NH3)2]+ + Cl- + 2 H2O
В этом случае концентрация ионов Ag+, присутствующих в насыщенном растворе AgCl за счет фазового равновесия
AgCl(т)  Ag+ + Cl-,
Ag+ + Cl-,
будет уменьшаться из-за их связывания в виде довольно прочных комплексных катионов диамминсеребра(I) с b 2(обр), равной 1,6 . 107. В результате произведение концентраций Ag+ и Cl- становится ниже значения произведения растворимости AgCl, и осадок растворяется.
· Голубой осадок гидроксида меди(II) под действием водного раствора аммиака также переходит в растворимое комплексное соединение синего цвета:
Cu(OH)2 + 4 NH3 . H2O  [Cu(NH3)4]2+ + 2 OH- + 4 H2O,
[Cu(NH3)4]2+ + 2 OH- + 4 H2O,
так как ион меди(II) образует очень прочный комплексный катион состава [Cu(NH3)4]2+, с константой образования b2(обр), равной 7,9 . 1012 . Процесс образования комплекса отвечает следующим реакциям:
Cu(OH)2(т)  Cu2+ + 2 OH-
Cu2+ + 2 OH-
Cu2+ + 4 NH3 . H2O  [Cu(NH3)4]2+ + 4 H2O,
[Cu(NH3)4]2+ + 4 H2O,
В растворе, содержащем комплексные катионы [Cu(NH3)4]2+, концентрация катионов Cu2+ весьма мала и недостаточна для достижения значения произведения растворимости гидроксида меди(II) (ПР = 5,6 . 10-20). Но при добавлении к раствору [Cu(NH3)4]2+ раствора сульфида аммония выпадает черный осадок CuS (ПР = 1,4 . 10-36), а комплексный ион разрушается:
[Cu(NH3)4]2+  Cu2+ + 4 NH3 . H2O
Cu2+ + 4 NH3 . H2O
Cu2+ + S2-  CuS(т)
CuS(т)
_________________________________
[Cu(NH3)4](OH)2 + (NH4)2S + 4 H2O = CuS(т) + 6 NH3 . H2O
Следовательно, концентрация ионов Cu2+, образующихся при диссоциации комплекса – иона тетраамминмеди(II), является достаточной для достижения произведения растворимости сульфида меди(II). Сульфид-ионы связывают ионы меди в осадок, практически нерастворимый в воде, концентрация Cu2+ понижается, и равновесие диссоциации [Cu(NH3)4]2+ смещается вправо, что приводит в конечном счете к разрушению комплекса.
· Образование одного более прочного комплексного соединения может привести в полной диссоциации и разрушению другого, менее прочного комплекса. Например, реакция:
[Ag(NH3)2]Cl + 2 KCN + 2 H2O = K[Ag(CN)2] + KCl + 2 NH3 . H2O
является практически необратимой из-за большого значения константы образования дицианоаргентат(I)-иона. Полные константы образования катиона диамминсеребра(I) и дицианоаргентат(I)-иона равны соответственно 1,6 . 107 и 7,1 . 1019. Это значит, что комплексный ион [Ag(CN)2]- прочнее, чем [Ag(NH3)2]+.
Из приведенных примеров видно, что возможность образования комплексного соединения в значительной мере зависит от значения полной константы образования bn. Чем оно больше, тем меньше в растворе свободных ионов комплексообразователя, тем прочнее, устойчивее к воздействию других веществ будет данный комплекс.
Устойчивость комплексных соединений зависит от прочности химической связи между комплексообразователем и лигандами, поэтому в зависимости от природы последних значение константы образования меняется в широких пределах.
Константы образования некоторых комплексов (25 °С)
| Реакции комплексообразования | bn |
Ag+ + 2 CH3COO-  [Ag(CH3COO)2]- [Ag(CH3COO)2]-
| 4,4 |
Co2+ + 6 NH3  [Co(NH3)6]2+ [Co(NH3)6]2+
| 2,5 . 104 |
Ag+ + 2 NH3  [Ag(NH3)2]+ [Ag(NH3)2]+
| 1,6 . 107 |
Cu2+ + 4 NH3  [Cu(NH3)4]2+ [Cu(NH3)4]2+
| 7,9 . 1012 |
Ag+ + 2 CN-;  [Ag(CN)2]- [Ag(CN)2]-
| 7,1 . 1019 |
Co3+ + 6 NH3  [Co(NH3)6]3+ [Co(NH3)6]3+
| 1,6 . 1035 |
Fe2+ + 6 CN-  [Fe(CN)6]4- [Fe(CN)6]4-
| 7,9 . 1036 |
Fe3+ + 6 CN-  [Fe(CN)6]3- [Fe(CN)6]3-
| 7,9 . 1043 |
Результаты многочисленных исследований показали, что устойчивость комплексных соединений в ряду комплексообразователей марганец(II) – железо(II) – кобальт(II) – никель(II) – медь(II) увеличивается, независимо от природы лиганда и координационного числа. Это так называемый “естественный порядок устойчивости”.
Только в немногих случаях обнаружены отклонения от этого ряда. Расположить подобным образом другие комплексообразователи оказалось невозможным.
При кристаллизации из раствора смеси некоторых солей с одинаковыми анионами образуются так называемые двойные соли. Так, при охлаждении водного раствора, содержащего хлориды калия и магния, кристаллизуется карналлит – двойная соль состава KCl . MgCl2 . 6 H2O, которая в водном растворе диссоциирует согласно уравнению реакции:
KCl . MgCl2 . 6 H2O + 6 H2O = [K(H2O)6]+ + [Mg(H2O)6]2+ + 3 Cl-
Точно так же при растворении в воде двойной соли – алюмоцезиевых квасцов состава CsAl(SO4)2 . 12 H2O происходит полная диссоциация:
CsAl(SO4)2 . 12 H2O = [Cs(H2O)6]+ + [Al(H2O)6]3+ + 2 SO42-
И в растворе, и в кристаллическом состоянии (в узлах кристаллической решетки) у этого соединения обнаруживаются аквакомплексы [Cs(H2O)6]+ и [Al(H2O)6]3+. Поэтому координационную формулу этого соединения следует записывать как [Cs(H2O)6][Al(H2O)6](SO4)2, а называть его сульфатом гексаакваалюминия-гексааквацезия. Что же касается карналлита, его точное название хлорид гексааквамагния-калия, а формула – K[Mg(H2O)6]Cl3.
В то же время при охлаждении водного раствора, содержащего хлориды калия и меди(II), кристаллизауется соединение, которое и в кристаллическом состоянии, и в растворе содержит комплексный анион [CuCl4]2-, полная константа образования b4(обр) которого равна 1,6 . 105. Следовательно, формулу кристаллизующегося в этом случае соединения надо записывать как K2[CuCl4] – тетрахлорокупрат(II) калия.
Таким образом, различие между комплексными соединениями и двойными солями состоит в том, что последние не координируют или очень слабо координируют анионные лиганды, и носит чисто количественный характер – они отличаются по значениям полных констант образования.
Глава 6. Квантовомеханические теории строения комплексных соединений
6.1. Теория валентных связей
6.2. Гибридизация атомных орбиталей и структура комплексов
6.3. Теория кристаллического поля
6.4. Цветность комплексных соединений
Теоретические представления о природе комплексообразования возникли из попыток дать объяснение химическому взаимодействию устойчивых молекул с ионами и атомами различных элементов – например, молекулы иода с иодид-ионом, молекулы монооксида углерода с атомами железа, кобальта, никеля и т.п.
Одновременно шел поиск причин заметной неспецифичности таких взаимодействий, в результате чего оказываются прочно связаны между собой и ионы, и атомы, и молекулы. Например, в хлориде дихлороакватриамминкобальта(III) [Co(NH3)3(H2O)Cl2]Cl с комплексообразователем связаны и хлорид-ионы, и нейтральные молекулы аммиака и воды.
Химические связи в комплексных (координационных) соединениях отличаются большим разнообразием, что обусловлено всевозможными сочетаниями ковалентных связей разной полярности, кратности и степени делокализации электронных пар.
В свое время было предложено много различных теорий связи в координационных соединениях, но значительная часть этих теорий уже стала достоянием истории. В настоящем разделе рассматриваются основные понятия только теории валентных связей (метода валентных связей) и теории кристаллического поля.
Теория валентных связей
Для образования ковалентных связей между комплексообразователем и лигандами необходимо, чтобы вакантные s-, p- или d-атомные орбитали… При этом часто происходит объединение неспаренных электронов… Неподеленные пары электронов лигандов взаимодействуют с гибридными орбиталями комплексообразователя, и происходит…Гибридизация орбиталей и структура комплексов
Переход 4s-электронов на 3d-подуровень превращает парамагнитный атом Ni0 в… Полученные вакантные орбитали подвергаются гибридизации, образуя тетраэдрическую конфигурацию. Так построен…Цветность комплексных соединений
Если через раствор или кристаллический образец вещества пропускать свет видимой части спектра, то в принципе возможны три варианта физического… Поглощение квантов света комплексами (например, имеющими октаэдрическое строение) объясняется взаимодействием света с…Глава 7. Типы комплексных соединений
7.1. Аквакомплексы
7.2. Гидроксокомплексы
7.3. Аммиакаты
7.4. Ацидокомплексы
7.5. Анионгалогенаты
7.6. Катионгалогены
7.7. Гидридные комплексы
7.8. Карбонильные комплексы
7.9. p-комплексы
7.10. Хелаты
7.11. Многоядерные комплексные соединения
Наиболее распространенной в настоящее время является классификация комплексных соединений по характеру координируемых лигандов.
Однако эта классификация в полной мере применима только для тех комплексных соединений, внутренняя сфера которых состоит из одинаковых лигандов. Тем не менее она позволяет объединить комплексы в определенные группы (типы) по общности методов синтеза и некоторых физико-химических свойств.
Аквакомплексы
К аквакомплексам относятся многие кристаллогидраты, например, [Al(H2O)6]Cl3 (иначе – AlCl3 . 6 H2O), [Cr(H2O)6](NO3)3 (иначе – Cr(NO3)3 . 6 H2O). … У некоторых кристаллогидратов часть молекул воды входит во внутреннюю, а…Гидроксокомплексы
[Al(H2O)6]3+ + H2O [Al(H2O)5(OH)]2+ + H3O+ либо при растворении амфотерных гидроксидов в водных растворах гидроксидов… Zn(OH)2 + 2 OH- = [Zn(OH)4]2-Аммиакаты
Аммиачные комплексы обычно получают при взаимодействии солей или гидроксидов металлов с аммиаком в водных или неводных растворах, либо обработкой… AgCl(т) + 2 NH3 . H2O = [Ag(NH3)2]Cl + 2 H2O Cu(OH)2(т) + 4 NH3 . H2O = [Cu(NH3)4](OH)2 + 4 H2OАцидокомплексы
Эту группу комплексных соединений можно подразделить на две части: комплексы с кислородсодержащими лигандами и комплексы с бескислородными… Ag+ + 2 SO3S2- = [Ag(SO3S)2]3- и гексанитрокобальтат(III)-ион, который осаждается в виде мелких желтых кристаллов калиевой соли при смешивании…Анионгалогенаты
Это комплексы состава M[ЭГ¢xГ²y], где М – малозарядный крупный катион, например, катион щелочного металла или аммония (а также алкил- или… Степень окисления комплексообразователя Э в анионгалогенатах может быть · положительной, например, в [IIIICl4]-,Катионгалогены
Все катионгалогены – сильнейшие окислители. Они бурно реагируют с водой и органическими растворителями. Синтез катионгалогенов возможен только с участием сильных акцепторов… ICl3 + SbCl5 = [ICl2][SbCl6]Гидридные комплексы
Гидридные комплексы – сильнейшие восстановители. Под действием кислот и в водной среде они разлагаются, выделяя водород: Na[AlH4] + 4 H2O = NaOH + Al(OH)3 + 4 H2 2 Na[BH4] + H2SO4 = Na2SO4 + B2H6 + 2 H2P-комплексы
Наиболее известным примером таких комплексов служит ферроцен – бис(циклопентадиенил)железо состава [Fe(C5H5)2]. Циклопентадиен С5H6 – соединение с… 2 Na + 2 С5H6 = 2 Na(C5H5) + H2 При действии циклопентадиенилнатрия Na(C5H5) на соль железа(II) в среде тетрагидрофурана выделяются оранжевые…Хелаты
Хелаты,или циклические комплексные соединения. Хелатами называют комплексные соединения, внутрення сфера которых состоит из циклических группировок, включающих комплексообразователь. Например, a-аминоуксусная кислота (глицин) может реагировать с гидроксидом меди с образованием сине-фиолетового прочного комплекса, растворимого в воде:
Cu(OH)2 + 2 NH2CH2COOH = [Cu(NH2CH2COO)2] + 2 H2O
Лиганд NH2CH2COO- (глицинат-ион) относят к категории бидентатных лигандов, образующих две химические связи с комплексообразователем – через атом кислорода карбоксильной группы и через атом азота аминогруппы:
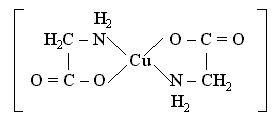
Внутренняя сфера комплекса содержит два замкнутых пятичленных цикла, в связи с чем полученный комплекс отличается высокой устойчивостью. Константа образования диглицинатомеди(II) b2 равна 1,8 . 1015.
Важное значение в химико-аналитической практике имеет открытая Л. А. Чугаевым реакция взаимодействия диметилглиоксима с катионами никеля(II) в аммиачной среде, приводящая к образованию малорастворимого ярко-красного комплексного соединения - бис(диметилглиоксимато)никеля(II)
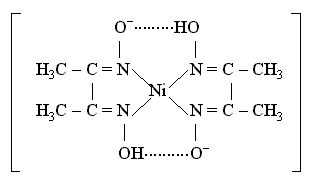
Функции лиганда в этом комплексном соединении выполняет диметилглиоксимат-анион
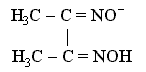
образующий две химические связи с комплексообразователем, вследствие чего получаются два пятичленных циклических фрагмента, упрочняющих комплекс.
Строение получаемого хелата плоское; благодаря внутримолекулярным водородным связям (между лигандами) образуются еще две шестичленные циклические группировки, включающие атомы никеля и стабилизирующие частицу комплекса.
Реакция Чугаева очень чувствительна и селективна по отношению к катионам никеля(II) и позволяют уверенно определить его присутствие в любых химических объектах, а получаемый хелатный комплекс используется как пигмент.
7.11. Многоядерные комплексные соединения.
К этому типу комплексов относят
- кластеры
- мостиковые соединения
- изо- и гетерополисоединения
Эти типы комплексов обычно рассматриваются при изучении химии элементов по группам Периодической системы.
Глава 8. Элементы Периодической системы Д.И. Менделеева: способность к образованию комплексов
8.1. Элементы s-секции
8.2. Элементы p-секции
8.3. Элементы d-секции
8.4. Лантаноиды и актиноиды
Способность химического элемента образовывать комплексы является одним из его важнейших свойств и определяется в основном строением электронной оболочки, т.е. положением элемента в Периодической системе Д.И. Менделеева. Под способностью элемента к комплексообразованию можно понимать как устойчивость образуемых ими комплексов, так и разнообразие их типов.
Для качественной сравнительной характеристики комплексообразующей способности элементов целесообразнее использовать способность элементов давать наибольшее количество комплексных соединений основных типов. Элементы, образующие лишь отдельные типы комплексных соединений, будем называть нетипичными комплексообразователями.
Ниже приводится краткий обзор комплексообразующей способности элементов в соответствии с их расположением в Периодической системе.
8.1. Элементы s-секции
s-элементы не относятся к типичным комплексообразователям (за исключением бериллия и отчасти магния). Для бериллия известен широкий круг комплексных ионов, например [BeF4]2-, [Be(OH)4]2-, [Be(CO3)2]2-, и внутрикомплексных соединений, причем в большинстве комплексов бериллия во внутреннюю сферу входят кислородсодержащие лиганды.
Способность к комплексообразованию во IIА-группе резко уменьшается по ряду Be > Mg > Ca > Sr > Ba > Ra и уже кальций, как и щелочные элементы, практически не имеет устойчивых комплексных соединений.
8.2. Элементы p-секции
p-элементы могут быть, в зависимости от положения в Периодической системе, и типичными комплексообразователями, и служить лигандами.
Для галогенов более характерна роль лигандов. Однако в анионгалогенатах такие элементы VIIA-группы, как At, I, Br выполняют и функции комплексообразователей.
У элементов VIA-группы - халькогенов - способность к комплексообразованию увеличивается от кислорода к полонию, по мере увеличения металличности. Теллур и полоний являются комплексообразователями в различных ацидокомплексах типа Cs[TeBr6].
Среди элементов VA и IVA-групп наибольшей склонностью к комплексообразованию обладают Sb, Bi, Sn и Pb, причем эти элементы образуют и различные многоядерные комплексные соединения.
Все элементы IIIA-обладают достаточно высокой комплексообразующей способностью. Минимальная способность к комплексообразованию наблюдается у элементов VIIIA-группы.
8.3. Элементы d-секции
d-элементы, как правило, являются типичными комплексообразователями, причем максимальная способность к комплексообразованию принадлежит элементам VIIIБ-группы. Вообще говоря, для d-элементов известны почти все типы комплексных соединений.
Характерной особенностью d-элементов является их способность образовывать прочные комплексы не только с анионными лигандами, но и с нейтральными, например, с молекулами CO, NH3, H2O, NO, ненасыщенными углеводородами и т.д.
Во многих комплексных соединениях d-элементы находятся в низшей степени окисления (часто – нулевой). Пониженная степень окисления элемента-комплексообразователя стабилизируется наличием d(p)-p(p)-связи с участием заполненных электронами орбиталей комплексообразователя и вакантных орбиталей лигандов.
Лантаноиды и актиноиды
Актиноиды (5f-элементы) более склонны к образованию комплексов, чем лантаноиды (4f-элементы). Это различие вызвано участием 5f-орбиталей в…Приложение 1. Терминология химии комплексных соединений
Адденд – устаревшее название лиганда (см.)
Аддукт – соединение неизвестного строения, например NH3 . BF3, образуется в результате реакции присоединения
Аквакатионы – комплексные катионы, в которых лигандами служат молекулы воды, например, [Al(H2O)6]3+
Аквакомплексы – комплексные соединения, содержащие аквакатионы и простые анионы, например: [Al(H2O)6]Cl3
Амбидентатный лиганд – лиганд, который может быть связан с комплексообразователем через разные атомы, входящие в его состав. Например, тиоцианатный лиганд NCS- может присоединяться к центральному атому комплекса через атом азота и через атом серы
Аммиакаты(аммины) – комплексные соединения, содержащие в качестве лигандов молекулы аммиака
Анионгалогенаты – комплексные соединения, содержащие анион, в котором комплексообразователь и лиганды – галогены, например, Cs[ICl4]
Ацидокомплексы– комплексные соединения, в которых лигандами служат анионы кислот, например K2[HgI4]
Внешняя сфера комплексного соединения – ионы и (или) молекулы, не находящиеся в непосредственной химической связи с комплексообразователем, но нейтрализующие заряд комплексного иона (внутренней сферы)
Внутренняя (координационная) сферакомплексного соединения – совокупность комплексообразователя и непосредственно с ним связанных лигандов
Внутрикомплексныесоединения – устаревшее название циклических соединений или хелатов
Высокоспиноваяэлектронная конфигурация – электронная конфигурация с максимально возможным числом неспаренных электронов на атомных или молекулярных орбиталях
Гидридныекомплексы – комплексные соединения, в которых лигандами служат гидридные анионы, например, Li[AlH4]
Гидроксокомплексы -комплексные соединения, в которых лигандами служат гидроксид-ионы, например, Na[Al(OH)4]
Дентатностьлигандов – число ковалентных связей, образуемых лигандом с комплексообразователем
Изомерия –существование соединений, одинаковых по составу и молярной массе, но различающихся строением, а следовательно, и свойствами
Изомерия геометрическая – вид внутрисферной изомерии, связанный с различным (например, цис- или транс-) расположением лигандов во внутренней сфере комплекса
Изомерия ионная –вид изомерии, связанный с различным распределением лигандов между внешней и внутренней сферой
Изомерия оптическая – вид внутрисферной изомерии, связанный с различным расположением лигандов во внутренней сфере комплекса, приводящим к появлению оптических изомеров (энантиомеров)
Карбонильныекомплексы – комплексы, в которых функции лиганда выполняет карбонил – монооксид углерода, например, [Ni(CO)4]
Катионгалогены – комплексные соединения, содержащие катион, в котором комплексообразователь и лиганды – галогены, например, [BrF2][AsF6]
Кластеры – многоядерные комплексные соединения, в которых атомы комплексообразователя связаны друг с другом непосредственно
Комплексообразователь (центральный атом) – атом, условный ион или молекула, координирующие лиганды и непосредственно с ними связанный
Комплекс внешнеорбитальный – такой комплекс, связи в котором образуются при участиии ns-, np- и nd-орбиталей комплексообразователя
Комплекс внутриорбитальный – такой комплекс, связи в котором образуются при участии ns-, np- и (n–1)d-орбиталей комплексообразователя
Константа образования (устойчивости) ступенчатая Ki – константа равновесия реакции образования комплекса на какой-либо i-ой ступени комплексообразования, с присоединением одного очередного иона (молекулы) лиганда
Константа образования (устойчивости) общая βi – константа равновесия реакции образования комплекса в случае присоединения данного числа лигандов к комплексообразователю
Координационное соединение – комплексное соединение
Координационная связь – химическая связь между комплексообразователем и лигандами
Координационное число –число химических связей комплексообразователя с лигандами
Лиганды –ионы и молекулы, непосредственно связанные с комплексообразователем во внутренней сфере комплекса
Лиганд бидентатный (тридентатный, полидентатный) – лиганд, образующий две (три, несколько) связей с комплексообразователем
Металлоцены -комплексы металлов, в которых лигандами служат циклопентадиенильные ионы, например, [M(C5H5)2]
Многоядерные комплексы – комплексы, содержащие во внутренней сфере два и более комплексообразователей
Мостиковые лиганды – лиганды, связывающие между собой два комплексообразователя во внутренней сфере
Низкоспиноваяэлектронная конфигурация – электронная конфигурация с максимально возможным числом спаренных электронов на атомных или молекулярных орбиталях
Параметр расщепления – разность энергии подуровней, получаемых при расщеплении d-подуровня в поле лигандов
Рацемат –смесь эквимолярных количеств оптических изомеров, не обладающая оптической активностью
Спектрохимический рядлигандов – последовательность лигандов, расположенных по росту их влияния на параметр расщепления
Хелаты (циклические соединения) – комплексные соединения с полидентатными лигандами, образующими в структуре циклы – замкнутые группировки атомов, включающие комплексообразователь
Хелат-эффект –повышение устойчивость комплексов при образовании в их структуре циклических фрагментов, включающих комплексообразователь
Энантиомеры - оптические изомеры, способные вращать плоскость поляризации света в противоположные направления
Приложение 2. Общие константы образования bi некоторых комплексов (водный раствор, 25 °С)
| Комплекс | bi |
| [Ag(CN)2]- | 7,1 . 1019 |
| [Ag(NH3)2]+ | 1,6 . 107 |
| [Ag(SO3S)2]3- | 2,9 . 1013 |
| [Al(H2O)2(OH)4]- | 3,2 . 1032 |
| [Be(OH)4]2- | 2,6 . 1018 |
| [Cd(H2O)2(OH)4]2- | 1,8 . 109 |
| [Cd(NH3)6]2+ | 1,4 . 105 |
| [Co(CN)6]3- | 1,0 . 1064 |
| [Co(NH3)6]2+ | 2,5 . 104 |
| [Co(NH3)6]3+ | 1,6 . 1035 |
| [Cr(OH)6]3- | 2,6 . 1014 |
| [Cu(CN)2]- | 1,0 . 1024 |
| [CuCl2]- | 3,5 . 105 |
| [Cu(NH3)2]+ | 7,2 . 1010 |
| [Cu(NH3)4]2+ | 7,9 . 1012 |
| [Cu(SO3S)2]3- | 1,7 . 1012 |
| [Fe(CN)6]4- | 7,9 . 1036 |
| [Fe(CN)6]3- | 7,9 . 1043 |
| [FeF4]- | 5,5 . 1015 |
| [Fe(H2O)3(NCS)3] | 4,3 . 104 |
| [Fe(H2O)4(HPO4)]+ | 7,8 . 1010 |
| [Fe(H2PO4)4]- | 1,4 . 109 |
| [Fe(NCS)6]3- | 1,7 . 103 |
| [HgI4]2- | 6,8 . 1029 |
| [Ni(NH3)6]2+ | 2,0 . 108 |
| [Pb(OH)3]- | 8,3 . 1013 |
| [Sn(OH)3]- | 8,5 . 1011 |
| [Sn(OH)6]2- | 1,0 . 1063 |
| [Zn(NH3)4]2+ | 4,2 . 108 |
| [Zn(OH)4]2- | 4,3 . 1016 |
Приложение 3. Общие константы образования bn некоторых комплексов (водный раствор, 25 °С)
| M | n | bn |
| Лиганд Br- | ||
| AgI | 2,2 . 107 | |
| AuI | 2,9 . 1012 | |
| AuIII | 3,2 . 1031 | |
| CuI | 8,3 . 105 | |
| HgII | 1,0 . 1020 | |
| PbII | 2,0 . 103 | |
| 1,0 . 103 | ||
| PdII | 1,3 . 1013 | |
| PtII | 3,2 . 1020 | |
| SnII | 1,4 . 102 | |
| 4,6 . 101 | ||
| Лиганд CH3COO- | ||
| AgI | 4,4 . 100 | |
| InIII | 2,0 . 1010 | |
| PbII | 4,8 . 102 | |
| 1,2 . 104 | ||
| 3,0 . 106 | ||
| 3,8 . 108 | ||
| Лиганд NH2C2H4NH2 (en) | ||
| AgI | 6,9 . 107 | |
| CdII | 1,9 . 1012 | |
| CoII | 6,6 . 1013 | |
| CoIII | 4,9 . 1048 | |
| CuI | 6,3 . 1010 | |
| CuII | 1,3 . 1020 | |
| FeII | 5,0 . 109 | |
| MnII | 4,7 . 105 | |
| NiII | 1,3 . 1019 | |
| Лиганд C5H5N (py) | ||
| AgI | 1,3 . 104 | |
| CdII | 3,1 . 102 | |
| CuI | 5,0 . 108 | |
| CuII | 3,5 . 106 | |
| FeII | 5,0 . 106 | |
| HgII | 2,5 . 1010 | |
| ZnII | 8,5 . 101 | |
| Лиганд CN- | ||
| AgI | 7,1 . 1019 | |
| AuI | 2,0 . 1038 | |
| AuIII | 1,0 . 1056 | |
| CdII | 1,3 . 1017 | |
| CoII | 1,2 . 1019 | |
| CoIII | 1,0 . 1064 | |
| CuI | 1,0 . 1024 | |
| FeII | 7,9 . 1036 | |
| FeIII | 7,9 . 1043 | |
| HgII | 9,3 . 1038 | |
| NiII | 1,0 . 1031 | |
| ZnII | 4,2 . 1019 | |
| Лиганд CO32- | ||
| CdII | 1,7 . 106 | |
| CuII | 1,5 . 1010 | |
| LaIII | 5,3 . 107 | |
| PbII | 1,6 . 108 | |
| Лиганд C2O42- | ||
| AlIII | 2,0 . 1016 | |
| BeII | 8,1 . 105 | |
| CeIII | 2,0 . 1011 | |
| CoII | 5,0 . 109 | |
| CuII | 2,0 . 1010 | |
| FeII | 1,7 . 105 | |
| FeIII | 1,6 . 1020 | |
| LaIII | 2,0 . 1010 | |
| MnII | 2,6 . 1019 | |
| NiII | 1,0 . 1014 | |
| PbII | 3,5 . 106 | |
| Лиганд Cl- | ||
| AgI | 1,8 . 105 | |
| AuI | 6,2 . 1011 | |
| AuIII | 2,0 . 1021 | |
| CdII | 7,9 . 102 | |
| CuI | 3,5 . 105 | |
| FeIII | 1,4 . 10- 1 | |
| HgII | 1,7 . 1015 | |
| IrIII | 1,0 . 1014 | |
| PbII | 7,1 . 101 | |
| PdII | 1,3 . 1015 | |
| SnII | 2,8 . 102 | |
| SnIV | 6,6 . 100 | |
| ZnII | 3,0 . 10- 2 | |
| Лиганд F- | ||
| AlIII | 6,8 . 1020 | |
| BeII | 9,3 . 1014 | |
| FeIII | 5,5 . 1015 | |
| GeIV | 3,7 . 1025 | |
| HI | 5,9 . 103 | |
| PbII | 2,6 . 103 | |
| ScIII | 1,5 . 1020 | |
| SnII | 1,0 . 1010 | |
| Лиганд HS- | ||
| AgI | 2,8 . 1018 | |
| CdI | 7,3 . 1020 | |
| FeII | 9,3 . 1010 | |
| PbII | 3,3 . 1016 | |
| ZnII | 1,3 . 1016 | |
| Лиганд I- | ||
| AgI | 5,5 . 1011 | |
| 4,8 . 1013 | ||
| BiIII | 8,9 . 1014 | |
| CdII | 2,6 . 105 | |
| CuI | 5,8 . 108 | |
| HgII | 6,8 . 1029 | |
| PbII | 8,3 . 103 | |
| PdII | 1,3 . 1015 | |
| ZnII | 3,1 . 10- 1 | |
| Лиганд NCS- | ||
| AgI | 1,7 . 108 | |
| AuI | 1,0 . 1023 | |
| AuIII | 1,0 . 1042 | |
| CdII | 8,1 . 102 | |
| CoII | 2,0 . 102 | |
| CrIII | 6,3 . 103 | |
| CuI | 1,3 . 1012 | |
| CuII | 3,3 . 106 | |
| FeII | 3,4 . 104 | |
| FeIII | 1,7 . 103 | |
| HgII | 1,6 . 1021 | |
| ZnII | 5,0 . 103 | |
| Лиганд NH3 | ||
| AgI | 1,6 . 107 | |
| AuI | 1,0 . 1027 | |
| AuIII | 1,0 . 1030 | |
| CdII | 2,3 . 107 | |
| CoII | 1,4 . 105 | |
| 2,5 . 104 | ||
| CoIII | 6,3 . 1030 | |
| 1,6 . 1035 | ||
| CuI | 7,2 . 1010 | |
| CuII | 7,9 . 1012 | |
| CoII | 2,0 . 102 | |
| HgII | 3,0 . 107 | |
| NiII | 7,8 . 107 | |
| 2,0 . 108 | ||
| TlIII | 1,0 . 1013 | |
| ZnII | 4,2 . 108 | |
| Лиганд N2H4 | ||
| CdII | 7,8 . 103 | |
| NiII | 5,8 . 102 | |
| 1,6 . 105 | ||
| 2,2 . 107 | ||
| 1,6 . 109 | ||
| 5,6 . 1010 | ||
| 9,8 . 1011 | ||
| ZnII | 7,6 . 103 | |
| Лиганд NO2- | ||
| AgI | 6,8 . 102 | |
| CdII | 6,5 . 103 | |
| 1,3 . 103 | ||
| HgII | 3,5 . 1013 | |
| Лиганд OH- | ||
| AgI | 9,8 . 102 | |
| AlIII | 3,2 . 1032 | |
| BeIII | 2,6 . 1018 | |
| CdII | 1,8 . 109 | |
| CrIII | 9,3 . 1027 | |
| 1,6 . 1021 | ||
| 2,6 . 1014 | ||
| CuII | 7,8 . 1015 | |
| GaIII | 2,0 . 1040 | |
| PbII | 8,3 . 1013 | |
| PtII | 4,7 . 1022 | |
| SnIII | 8,5 . 1011 | |
| SnIV | 1,0 . 1063 | |
| ZnII | 4,3 . 1016 | |
| Лиганд P2O74- | ||
| CuI | 5,2 . 1026 | |
| CuII | 2,8 . 1012 | |
| FeIII | 3,6 . 105 | |
| NiII | 1,6 . 107 | |
| PbII | 2,5 . 109 | |
| SnII | 2,5 . 1016 | |
| ZnII | 1,0 . 1011 | |
| Лиганд SO32- | ||
| AgI | 4,0 . 105 | |
| 4,8 . 108 | ||
| 1,0 . 109 | ||
| CdII | 1,6 . 104 | |
| CuII | 7,1 . 107 | |
| 5,0 . 108 | ||
| 2,3 . 109 | ||
| HgII | 1,2 . 1024 | |
| Лиганд SO3S2- | ||
| AgI | 2,9 . 1013 | |
| CdII | 2,9 . 106 | |
| CuI | 1,9 . 1012 | |
| CuII | 1,7 . 1012 | |
| 6,9 . 1013 | ||
| HgII | 6,3 . 1030 | |
| 1,8 . 1032 | ||
| 4,1 . 1033 | ||
| PbII | 1,4 . 105 | |
| 2,2 . 106 | ||
| 1,6 . 107 | ||
| ZnII | 3,9 . 104 |
Приложение 4. Эффект Яна - Теллера (общие сведения)
Теория кристаллического поля предсказывает, что когда в октаэдрическом поле лигандов на dγ- подуровне центрального атома одна орбиталь занята неспаренным электроном или парой электронов, а вторая орбиталь свободна, то происходит снятие энергетического вырождения dγ-подуровня (разделение дважды вырожденного дублета на два невырожденных синглета) - эффект Яна - Теллера.
В слабом поле лигандов это имеет место для центральных атомов с конфигурацией dε3dγ1 и в сильном поле лигандов - для центральных атомов с конфигурациями dε6dγ1 и dε6dγ2:
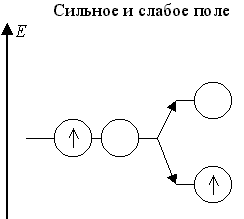
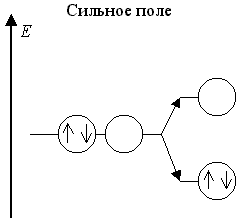
Оставшаяся свободной dγ-АО участвует в dsp3d-гибридизации. Примерами октаэдрических частиц с такими центральными атомами в слабом поле являются комплексы [CrII(H2O)6]2+ и [MnIII(C2O4)3]3-, а в сильном поле [CoII(NO2)6]4- и [NiII(NO2)6]4-.
В геометрическом смысле эффект Яна - Теллера приводит к тетрагональному искажению октаэдрической формы комплексов [ML6] с dsp3d-гибридизацией орбиталей центрального атома, т.е. чаще всего к удлинению двух осевых связей M - L и укорочению четырех экваториальных связей M - L (реже - наоборот). Большое тетрагональное искажение приводит к октаэдру, сильно вытянутому вдоль выбранной оси. Поэтому наблюдается почти полное исчезновение влияния двух осевых лигандов, и в гибридизации прекращается участие одной np- и одной nd-АО.
Формула гибридизованных орбиталей уменьшается на pd, т.е. реализуется dsp2-гибридизация.
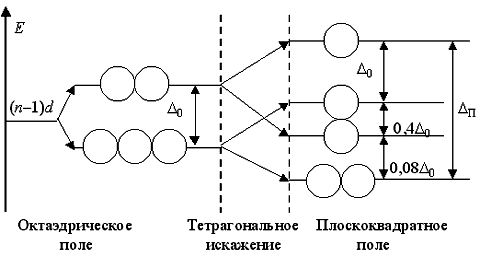
В этом случае октаэдрический комплекс [ML6] фактически превращается в плоскоквадратный [ML4]. При этом снимается также вырождение dε-подуровня.
Поэтому, например, атом NiII в сильном поле лигандов чато образует не октаэдрические, а плоскоквадратные комплексы типа [Ni(CN)6]2-, а для центральных атомов PdII и PtII все комплексы будут плоскоквадратными.
Приложение 5. Тетраэдрическое поле лигандов (общие сведения)
Помимо октаэдрического, существует другое высокосимметричное и достаточно распространенное тетраэдрическое поле лигандов, где (n-1)d-подуровень центрального атома с КЧ = 4 расщепляется иначе, чем в октаэдрическом поле.
Очевидно, что сила поля четырех лигандов меньше силы поля октаэдрического поля, и параметр расщепления тетраэдрическим полем ΔТ всегда меньше, чем для октаэдрического поля (и составляет, по расчетным данным, 0,44Δ0).
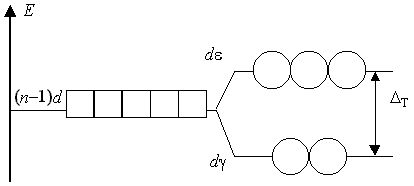
Для 3d-элементов с незаполненным 3d-подуровнем образование тетраэдрических комплексов происходит только в слабом поле лигандов; в сильном поле формируются плоскоквадратные комплексы (КЧ = 4).
При конфигурации 3d10 всегда образуются тетраэдрические комплексы (проявление эффекта Яна - Теллера невозможно).
В зависимости от числа 3d-электронов осуществляются различные типы тетраэдрической гибридизации:
| Электронная конфигурация | Тип гибридизации | Форма частиц |
| nd1, nd2 | d3s | Тетраэдрическая |
| nd3 | d2sp | Плоскоквадратная |
| nd4, nd5, nd6, nd7, nd8, nd9, nd10 | sp3 | Тетраэдрическая |
Например, в тетраэдрических комплексах с центральным атомом FeIII (d5) реализуется sp3-гибридизация; в ней участвуют 4s- и 4p-АО железа (поскольку все 3d-АО железа заняты неспаренными электронами - поле лигандов слабое).
Примерами тетраэдрических частиц с центральными атомами 3d-элементов являются:
TiIVCl4 (d0), VIVCl4 (d1),
FeVIO42- (d2), [CrIIIF4]- (d3),
[FeIIICl4]- (d5), [FeIICl4]2- (d6),
[CoIICl4]2- (d7), [NiIICl4]2- (d8),
[CuIIBr4]2- (d9) и [ZnII(H2O)I3]- (d10).
– Конец работы –
Используемые теги: Комплексные, соединения0.046
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Комплексные соединения
Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов