P-комплексы
p-комплексы (пи-комплексы) – это комплексные соединения, в которых в роли лигандов фигурируют ненасыщенные органические молекулы типа этилена, циклопентадиена, бензола и т.п.
Наиболее известным примером таких комплексов служит ферроцен – бис(циклопентадиенил)железо состава [Fe(C5H5)2]. Циклопентадиен С5H6 – соединение с двумя двойными связями. Он является очень слабой кислотой. При взаимодействии с металлическим натрием образуется циклопентадиенилнатрий Na(C5H5) с анионом С5Н5-:
2 Na + 2 С5H6 = 2 Na(C5H5) + H2
При действии циклопентадиенилнатрия Na(C5H5) на соль железа(II) в среде тетрагидрофурана выделяются оранжевые кристаллы бис(циклопентадиенил)железа:
FeCl2 + 2 Na(C5H5) = [Fe(C5H5)2] + 2 NaCl
Структура этого соединения напоминает сэндвич или бутерброд:
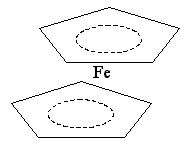
Комплекс диамагнитен, а комплексообразователь – Fe(II) находится между циклическими анионами С5Н5- на равном расстоянии от всех атомов углерода.
Выделить в бис(циклопентадиенил)железе отдельные ковалентные связи между комплексообразователем и атомами лиганда нельзя: центральный атом образует связь со всей p-электронной системой лиганда.
В частице ферроцена донором электронных пар являются циклопентадиенил-ионы, каждый из которых предоставляет по три пары p-электронов. Акцепторами этих электронных пар служат sp3d2-гибридные орбитали железа(II).
Поскольку образуются шесть многоцентровых связей, которые упрочняются по дативному механизму (за счет электронных пар атома железа), валентные штрихи, обозначающие связь металл – лиганд, теряют свой обычный смысл. Следовательно, к p-комплексам относят те комплексы, у которых в образовании связи M – L участвуют p-электроны всего лиганда, а не какого-либо отдельного атома.