Координационное число 4
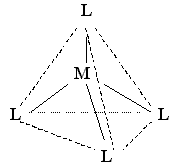
Для соединений с координационным числом 4 имеются две возможности пространственного расположения лигандов. Это, во-первых, тетраэдрическое размещение лигандов с комплексообразователем в центре тетраэдра (sp3-гибридизация атомных орбиталей комплексообразователя):
Во-вторых, возможно плоскоквадратное расположение лигандов вокруг находящегося в центре квадрата атома комплексообразователя (гибридизация типа dsp2): 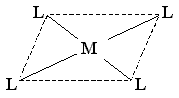
Большинство комплексных соединений, имеющих координационное число 4, построено тетраэдрически. Такая геометрия координационной сферы чаще всего энергетически несколько выгоднее квадратной.
Примерами могут служить тетраэдрически построенные комплексные ионы [BF4]-, [ZnCl4]2-, [Hg(CN)4]2-, [Zn(NH3)4]2+.
Плоскоквадратная конфигурация комплексов типична для таких комплексообразователей, как Pt(II), Ni(II), Cu(II) и некоторых других.
Например, квадратное строение имеют следующие комплексные ионы: [PtCl4]2-, [Ni(CN)4]2-, [Cu(NH3)4]2+.
Интересно, что для Pt(II) получены комплексные соединения разных видов, от комплексного катиона до комплексного аниона, причем во всех случаях геометрическая конфигурация комплексов плоскоквадратная:
[Pt(NH3)4]2+ ® [Pt(NH3)3Cl]+ ® [Pt(NH3)2Cl2]0 ® [Pt(NH3)Cl3]- ® [PtCl4]2-