рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Литературный обзор
Реферат Курсовая Конспект
Литературный обзор
Литературный обзор - раздел Химия, Медь-калий-молибденсодержащие нанесённые катализаторы на основе оксида алюминия В Настоящее Время Производственные Методы Получения Формальдегида Большим Раз...
В настоящее время производственные методы получения формальдегида большим разнообразием не отличаются. Так, в реакциях восстановления СО и СО2 водой выход СН2О очень мал. Внимание химиков уже давно привлекала реакция гидрирования оксида углерода
СО+Н2 ↔СН2О (1)
Тем более, что эта реакция может рассматриваться как этап процесса получения метанола:
СО + 2Н2 →СН3ОН (2)
Однако термодинамический расчет показывает, что равновесие реакции (1) сильно смещено влево. Даже при давлении 100 МПа равновесная концентрация формальдегида не достигает 2%, а при 10 МПа и ниже измеряется сотыми и тысячными долями процента. Возможным выходом из термодинамических ограничений является быстрый и полный вывод образовавшегося формальдегида из зоны реакции.
Основной производственный метод получения формальдегида во всем мире уже много лет – каталитическое взаимодействие метанола с кислородом воздуха:
СН3ОН + ½ О2 →СН2О + Н2О (3)
Исторически первый вариант окислительной конверсии метанола – процесс с применением металлических, в настоящее время (в основном) серебряных катализаторов. Однако в последние десятилетия за рубежом довольно большое распространение получила и существенно отличная технология с использованием оксидных контактов.
2.1 Получение формальдегида на металлических катализаторах.
Окислительная конверсия метанола в присутствии раскаленной меди (сетка, спирали, трубки) относится к числу старейших химических процессов. В 20-х годах многими исследователями было показано, что серебро и его сплавы более эффективны в качестве катализаторов, чем медь. В последующие годы серебряные катализаторы полностью вытеснили медные, хотя патенты на применение катализаторов на основе меди продолжают появляться и в самое последнее время.
Окислительная конверсия метанола на серебре проводится при соотношении метанол: воздух выше верхнего предела взрывной концентрации, то есть при большом избытке метанола по отношению к кислороду.
Детальные исследования показали, что процесс описывает более чем десяток индивидуальных маршрутов реакций.
Собственно образование формальдегида осуществляется в результате протекания параллельных реакций дегидрирования и парциального окисления метанола [2]
СН3ОН → СН2О + Н2 - 93,4 кДж/моль (4)
СН3ОН + 1/2 О2 → СН2О + Н2О + 147,4 кДж/моль (5)
Наряду с этими реакциями в системе протекает целый ряд побочных превращений.
СН3ОН + 3/2О2 → СО2 + 2 Н2О + 575,1 кДж/моль (6)
СН2О + 1/2О2→ НСООН + 270,4 кДж/моль (7)
НСООН + 1/2О2→СО2 + Н2О + 14,5 кДж/моль (8)
НСООН → СО + Н2О - 53,7 кДж/моль (9)
СН2О → СО + Н2 + 1,9 кДж/моль (10)
2СН2О + Н2О → СН3ОН + НСООН + 122,0 кДж/моль (11)
Н2 + 1/2О2 → Н2О + 241,8 кДж/моль (12)
2СН3ОН + СН2О → СН2(ОСН2)2 + Н2О + 131,0 кДж/моль (13)
СО + 1/2О2 → СО2 + 283,0 кДж/моль (14)
2СО → СО2 + С + 172,5 кДж/моль (15)
Превращение метанола в формальдегид происходит в результате контакта молекул спирта с кислородом, хемосорбированным на атомах серебра. Так как за счет восстановления оксидной пленки, всегда имеющейся на поверхности серебра, соприкасающегося с воздухом, превращение метанола в формальдегид в течение некоторого времени наблюдается и в отсутствие кислорода в сырье.
Окисление метанола в формальдегид проводится при температуре 650°С и атмосферном давлении. Это хорошо освоенный технологический процесс (BASF).
Имеется ряд патентов, рекомендующих для повышения эффективности процесса вводить различные органические и неорганические добавки в исходную смесь. Так, введение (6-7)*10-3 % фенола или креозолов (в пересчете на метанол) повышает конверсию спирта на 10%. Добавление (10-13)*10-3% тяжелых масел (содержащих спирты С8 – С14, диалкильные эфиры С8 – С10) предупреждает пенообразование при испарении спирта и увеличивает выход формальдегида. Введение (2-3)*10-2% диметил- и триметиламина, пиперидина, пирролидона снижает кислотность формалина в 50 раз.
Известно, что активность многих катализаторов можно повысить внедрением небольших количеств веществ, которые сами по себе для данного процесса – яды. Типичными каталитическими ядами для серебряных контактов, являются пентакарбонил железа, соединения серы, фосфора, мышьяка, галогенов, селена, теллура и др. некоторые из этих веществ – эффективнейшие модификаторы. Так, в работе [7] модифицирование серебряного контакта проводилось добавками селена и теллура (0,1 % к массе серебра). При таком содержании эти добавки подавляют реакцию полного окисления метанола до диоксида углерода, что позволяет повысить мольное отношение О2:СН3ОН до 0,41-0,45. При этом, по данным авторов, конверсия метанола возрастает до 95-100%, а селективность процесса до 93-95%. Имеют предложения использовать так же сплавы серебра с селеном или сурьмой с содержанием последних 0,5-12,0%. Однако при длительной работе показатели процесса ухудшаются из-за уноса модификаторов с поверхности катализатор. В связи с этим многими авторами рекомендуется способ непрерывной подачи микродобавок в газовую смесь, поступающую на контактирование. Так, введение серы (от 5 до 100 ч. На 1 млн. ч. спирта) приводит к значительному подавлению побочных реакций. Некоторые исследователи предлагают вводить галогенпроизводные как в виде бромо- и хлороводорода [36], так и в виде других соединений: хлорида фосфора(III), йодида аммония и т.д. [11]. Рекомендуемое содержание галогенпроизводных в газовой смеси – 10-5-10-6 моль на 1 моль метанола. Недостаток этого способа – загрязнение формалина модификаторами, что вызывает необходимость очистки продукта, например анионитами.
Большое распространение приобрело модифицирование серебряного катализатора различными металлами и их оксидами. Так, было выявлено промотирующее действие оксидов цинка, бериллия, циркония, сурьмы (III), марганца (VI), железа (VI), кальция, натрия, титана в той или иной степени ингибируют процесс окислительного дегидрирования метанола [8]. Имеется ряд патентов, в которых рекомендуется применять сплавы серебра с медью, теллуром, кадмием [9] и золотом. Если содержание кадмия в сплаве составляет 4-15%, то рекомендуемое соотношение золота с серебром составляет от 0,5:1 до 1:1. В обоих случаях выход повышается на 4-5%. Степень превращения метанола на серебре и его сплавах с различными добавками, за исключением цинка, германия, галлия, висмута возрастает с увеличением отношения О2:СН3ОН. Селективность процесса окисления в формальдегид на серебре и его сплавах с теллуром нечувствительна к повышению этого отношения, тогда как у сплавов серебра с германием, галлием и индием – увеличивается, а у остальных уменьшается. Введение в серебро 10% магния [15], меди и кадмия увеличивает дегидрирующую способность катализатора, повышая тем самым общую конверсию метанола, а присутствие селена и сурьмы увеличивает селективность процесса. Существенно пониженной каталитической активностью обладают сплавы серебра с цинком, галлием и германием. Сплавы серебра с алюминием, теллуром, оловом по сравнению с чистым серебром также проявляют пониженную активность. Для сплавления с серебром рекомендуется платина (0,45-0,75%) [16]. Есть указания на целесообразность применения в качестве добавок и оксидов некоторых металлов: молибдена (VI) (141), титана (IV), магния и кальция . В последнем случае массовая доля серебра составляет от 5 до 30% от всего катализатора. Предложено использовать в качестве добавок к серебру пероксиды щелочных и щелочноземельных металлов , а так же соли серебра – карбонаты и оксалаты . Однако сведений о практическом применении сплавов и модифицирующих добавок пока нет.
По мнению некоторых исследователей, конверсию метанола можно повысить, практически без потерь селективности, если слой катализатора секционировать. Наибольший эффект был получен при использовании многослойных с ненанесенным катализатором. Применение системы из нескольких слоев серебра, обладающего высокой теплопроводностью, по-видимому, позволяет в значительной мере уменьшить адиабатический разогрев.
В начале 60-х годов японская фирма Sumitomo получила патент на использование трехслойного компактного катализатора, причем верхние два слоя представляли собой кристаллы размером 0,8— 1,0 мм, а нижний слой — серебро в воде тонких нитей [19].
По предложению фирмы BaSF серебряный катализатор делится на четыре слоя общей высотой 20—30 мм, а серебряное кольцо по периметру реактора выполняет функции пятого слоя. Характерной особенностью патентов фирмы является применение бидисперсных гранул серебра. Так, в нижней части слоя рекомендуется размещать гранулы с размером менее 0.3 мм, количество которых составляет 1/8 от общего количества серебра. Оставшаяся часть катализатора в виде гранул размером до 1—3 мм насылается поверх мелких частиц [6,10]. Выход формальдегида по одному из примеров равен 88%. Применение двухслойного катализатора позволяет проводить процесс с конверсией метанола до 97,4% при селективности 89—90% [12].Многослойные серебряные катализаторы нашли применение на практике.
Результатом усовершенствований процессов предусматривались и новые катализаторы. Так, в патенте [18] рекомендуется — применять в качестве контакта второй секции состав, приготовленный спеканием двух разных типов серебряного катализатора. Верхний слой (высота 10—100 ми) имеет объем пор 75 90%, пористость нижнего слоя (высота 5—20 мм) — 65—75%, Также рекомендуется применять сплав серебра с золотом в соотношении Ag:Au=50:50 и -10:60 при температуре реакции на обеих секциях не выше 600вС. Максимальное мольное отношение О2:СН3ОН также не превышает 0,5. В этом варианте достигаются следующие показатели: конверсия метанола 98,0—98,6%, мольная селективность 88,1—89,6%. В случае проведения процесса с использованием указанного сплава на одной секции конверсия составляла 89,8%, а мольная селективность 91,8%.
2.2 Получение формальдегида на оксидных катализаторах
Первое подробное исследование по получению формальдегида из метанола в присутствии смеси оксидов железа и молибдена проведено в начале 30-х годов [13]. Обширный поток публикаций по научному обоснованию и технологии применения оксидных контактов возник в конце 50-х годов, после появления информации о промышленной реализации метода вначале фирмой du Pont de Nemours, а затем Keichhold Chemical, Monlecalini, Lummus и др. В Советском Союзе систематические исследования в данной области проводятся, главным образом, Боресковым и его школой [37], причем некоторые варианты технологии доведены до стадии опытно-промышленной проверки [14,17].
Каталитическая активность оксидов металлов (т. е. конверсия метанола) меняется в ряду MoO3 < TiO2 < Fe2O3 < Cr2O3 < NiO < V2O5 < Mn2O3 < CuO < Co3O4, а селективность по формальдегиду почти в обратной последовательности: Co3O4< CuO < Fе2O3 < Mn203 < Cr203 < NiO < V2Os < TiO2 < MoO3 [20]. Как показал Попов , соответствующие показатели по селективности для молибдатов металлов меняются в рядах Na ≈ Ca < Sr ≤ Ni < MoO3 < Ba< Pb < Cr <Cd ≤ Bi < Co < Fe и Cr < Co < Fe < Bi< Cd <Ni <Ba < Ca < Na < Pb. Однако наибольшей эффективностью по обоим показателям обладают катализаторы, содержащие избыточный оксид. В этом случае наблюдаются следующие последовательности: по активности — MoO3 < Na <Sr ≤ Ni < Pb < Ba < Cd < Co < Ca < Bi < Cr < Fe, а по селективности — Ва ≈ Sr < Ni < Ca < Bi ≈ Pb < Co < Cd < Cr ≈ Fe.
На практике в качестве катализатора наибольшее распространение получила смесь оксидов железа(III) и молибдена(VI) МоО3 с атомным соотношением молибдена к железу от 1,7 да 2,5. Готовят катализатор соосаждением подходящей соли железа (III), например, хлорида или нитрата, с молибдатом аммония. Окисные катализаторы значительно менее чувствительны к примесям, чем серебряный и его аналоги.
Сопоставляя достоинства и недостатки обоих методов, естественно предположить, что первые можно объединить, а вторые, в известной мере уменьшить, если вначале пропустить метанол через серебряный, а затем через оксидный контакт. Первое предложение было сделано Пэйном. На первой секции предлагалось поместить кристаллическое серебро, а на второй (но ходу сырья) — оксидный железо молибденовый катализатор. Поскольку реакция на серебряном катализаторе проводится в недостатке, а на оксидном в избытке кислорода, к смеси газообразных продуктов, выходящей из секции, добавляется расчетное количество воздуха. Как следует из описания патента, суммарная мольная конверсия метанола после обеих секций составляет 99,1%. при мольной селективности образования формальдегида 90,5%. В других патентах для второй секции рекомендуются окисные катализаторы, содержащие оксиды фосфора, висмута, молибдена и др.
Комбинированная система из трегерного серебряного и оксидного железомолибденового катализатора обеспечивает практически полную конверсию метанола при мольной селективности около 90%. Содержание формальдегида в контактном газе составляет 17—20%, что приближается к соответствующему значению для односекционного реактора с серебром (21 - 23%) и значительно превосходит этот показатель для односекционного реактора с оксидным контактом (6—8%). Однако практическая реализация комбинированного катализатора встречает ряд трудностей. Так перепад температур между секциями достигает 400°С и более, что сложно реализовать в одном блоке. Обращает на себя внимание большая разница в объемах катализатора на первой и второй секциях (≈ в 25 раз). При добавлении воздуха и смеси газообразных продуктов из первой секции необходимо перейти через область взрывных концентраций.
2.3 Окисление природного газа и низших олефинов.
С точки зрения доступности и дешевизны сырья, а также простоты технологии, получение формальдегида прямым окисленной природного газа, состоящего, в основном, из метана, кислородом воздуха заслуживает предпочтения перед сравнительно сложным и многостадийным синтезом формальдегида через метанол, что видно из схемы:
природный газ —► синтез-газ —► метанол —► формальдегид.
Однако на практике получение формальдегида прямым окислением метана сопряжено с целым рядом трудностей, важнейшие из которых связаны с недостаточной устойчивостью формальдегида в условиях реакции. Известно, что гомогенное окисление метана с заметной скоростью происходит при температуре выше 600°С. В то же время термическое разложение формальдегида наблюдается уже при 400°С [21]. Образовавшийся формальдегид, кроме того, в присутствии кислорода, легко подвергается дальнейшему окислению. В силу этих причин на практике окисление метана проводят при малых значениях конверсии, причем и в этих условиях селективность образования формальдегида не высока.
Гомогенное окисление метана представляет собой типичную свободнорадикальную реакцию. В отсутствии инициаторов реакция характеризуется наличием индукционного периода. Для устранения или уменьшения последнего к метано-воздушной смеси добавляют вещества, легко распадающиеся на свободные радикалы — чаще всего азотную кислоту или оксид азота (II), а также озон, пероксид водорода, галогены, галогеноводороды и галоген алкилы, летучие алкилы свинца и т.д. [29,30]. В работах [32] в качестве инициатора рекомендуется применять диметиловый эфир, не загрязняющий продукты реакции посторонними примесями.
С целью интенсификации процесса окисления предложен целый ряд гетерогенных катализаторов. При 600–700°С ускоряющее действие на превращение метана, по-видимому, оказывают многие твердые материалы, например алюмосиликаты, кварц и т. п., благодаря наличию геометрически и энергетически неоднородных участков поверхности и, в особенности, кислотных центров. Реакцию можно проводить как в стационарном, так и в кипящем слое. Для повышения активности алюмосиликаты пропитывают растворами кислот, например фосфорной, борной. Значительное число работ посвящено применению контактов, на которые нанесены оксиды различных элементов, главным образом металлов [33,34]. Контакт, представляющий собою шарики из алюмосиликата диаметром 0,75 мм (катализатор для крекинга нефтепродуктов), на которые было нанесено 1,5% оксида железа(III), обеспечивал выход формальдегида 1,8- 1,9% на пропущенный метан, а катализатор с 3—7% оксида магния 2,1—2,3%. Несколько более высокие показатели были получены с катализатором, в котором в качестве носителя применился алюмосиликат, содержащий 10—11% оксида алюминия, а в качестве активного компонента – фосфат церия (2%) и оксид фосфора (0,05-0,06%). В этом случае при 750°С выход формальдегида составлял 2,6%.
Отдельную группу составляют трегерные катализатopы на основе металлов I группы, а также палладия. Так, в присутствии катализатора 0,5% Pd/Al203, и небольших добавок галогеналкилов конверсия метана при 480°С составила 22,6%, а селективность образования формальдегида 34% (201). Трегерные контакты, содержащие медь или серебро, по-видимому, сходны с катализаторами окислительной конверсии метанола.
Производство формальдегида инициированным гомогенным газофазным окислением природного газа создано в ФРГ фирмой Gutcbolfnungshutte АО. В качестве инициатора применяется смесь оксидов азота. Последняя получается в рамках основного производства сжиганием аммиака над платиновым катализатором.
По методу фирмы Hibcrnia метан окисляется с применением кислорода с добавкой озона. Для дополнительного инициирования реакции используют пероксид бария. Процесс проводится при атмосферном давлении и 120°С. Соотношение кислород : метан составляет 2:3. Выход формальдегида равен 26,4% oт теоретического. Распространению процесса препятствует высокая стоимость озона.
Первая промышленная установка по получению формальдегида и других кислородсодержащих продуктов окислением смеси простейших алканов была сооружена в г. Толланте (США) в 1926 г. Окислению подвергался газ, содержащий 25% этана. Судя по патентному описанию, процесс проводится при 430— 480°С и давлении от 0,7 до 2 МПа, в присутствии твердого катализатора, представляющего собой смесь фосфата алюминия с оксидами металлов. Сконденсированный жидкий продукт содержал 34—36% метанола, 20—23% формальдегида и 5—6% ацетальдегида, а также небольшие количества ацетона, метилаля, воды и т. д.
Запатентован способ получения формальдегида, включающий каталитическое окисление метилаля на катализаторе, состоящем из оксидов железа, молибдена, щелочного металла Bi, Cr,W,Co,Ni. Смесь метилаля и кислорода пропускают через слой катализатора, поддерживая отношение 7,0≥х≥2,0 и 1,04Y – 3,9 ≥ х ≥ 1,04Y – 5,9, где х – процент вводимого метилаля, Y – объемный процент вводимого кислорода. Меняя х- ы процесса можно в течение длительного времени поддерживать высокими конверсию и селективность, получая целевой продукт с высокой производительностью.
А так же способ получения формальдегида, включающий газофазное окисление метанола 0,1-60% раствором азотной кислоты при мольном отношении метанол/азотная кислота >2 в атмосфере инертного или окисляющего газа при 150 - 350°С в присутствии V2O5 или MoO3 в качестве катализатора и воды или водяного пара.
Так же известен способ получения формальдегида путем каталитического неокислительного дегидрирования метанола.
Разработан одностадийный процесс получения формальдегида неокислительным каталитическим дегидрированием метанола с конверсией его не менее 80%, селективностью по формальдегиду до 75-90% при температурах 800-900°С [35,27].
Предложенный способ является альтернативой существующей промышленной технологии получения формальдегида по методу окислительного дегидрирования метанола в присутствии серебряных или железо-молибденовых катализаторов, который характеризуется рядом существенных недостатков. Образующийся в процессе водород может быть использован как товарный продукт или направляться на гидрирование диоксида углерода с получением метанола и возвращением последнего в рецикл. Вовлечение СО2 в реакцию получения метанола, который возвращается в рецикл, с использованием выделяющегося при дегидрировании водорода решает важную экологическую задачу утилизации СО2, снижая тем самым парниковый эффект.
Процесс дегидрирования метанола, осуществленный на цинк-медных катализаторах при 600°С, пока не получил широкого развития, однако он является очень перспективным, поскольку позволяет получать формальдегид, не содержащий воды [31].
2.4 Механизм каталитических реакций формальдегида из метанола.
Исследованию механизма превращения спиртов с применением ИК-спектороскопии касаются в основном механизма гидратации этих молекул и лишь в последние годы появились работы по изучению роли поверхностных соединений, образующихся при адсорбции спиртов и смесей спирт-кислород, в реакции окисления на катализаторах окислительного действия [4].
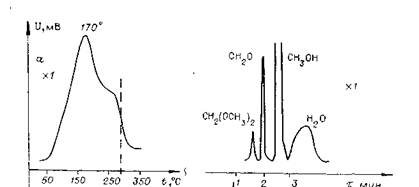 Рис. 1. Термодесорбированные спектры метанола, адсорбированного при 25°С, и хроматограммы продуктов десорбции
Рис. 1. Термодесорбированные спектры метанола, адсорбированного при 25°С, и хроматограммы продуктов десорбции
|
Используя концепцию об определяющей роли влияния центров поверхности на формы адсорбции, можно следующим образом классифицировать типы поверхностных соединений спиртов на оксидных катализаторах: водородносвязанный спирт с поверхностными гидроксильными группами и кислородом поверхности, спектральные характеристики которого мало отличаются от газообразного спирта (такие формы являются слабосвязанными).
На катализаторах Cr2O3, Fe2O3, CuO при адсорбции спирта при температуре происходит образование окисленных комплексов типа формиатов; на двуокиси титана они образуются лишь в присутствии кислорода в газовой фазе и при повышенных температурах, а на катализаторах, парциального окисления (МоО3, Fe/ Мо окисном) образования таких структур вообще не обнаружено [5].
С целью выяснения направлений превращений различных форм адсорбции метанола было изучено взаимодействие кислорода с поверхностью катализаторов, па которых метанол был предварительно адсорбирован раздельно в каждой из форм с дальнейшей термодесорбцией и анализом продуктов. Видно, что формальдегид образуется из слабохемосорбированного, а СО и СО2 , — из прочнохемосорбированного метанола. Так же как и в случае углеводородов, образование продуктов окисления облегчается в присутствии кислорода в газовой фазе (десорбция начинается при более низкой температуре, например для Ti02 Едес снижается со 160 до 135 кДж/моль).
Изучение превращений поверхностных структур под действием кислорода газовой фазы, и сопоставление их с результатами термодесорбции (например, для Ti02) позволили показать, что координационно связанный метанол может прекращаться в формальдегид, внося том самим вклад в образование продуктов парциального превращения. Исчезновение частот, относящихся к слабосвязанной метоксильной структуре при ~250°С, и появление в качестве продукта десорбции формальдегида свидетельствуют об определяющем вкладе именно этих структур в образование продукта мягкого окисления. Прочнохемосорбированные метоксильные группы под действием кислорода газовой фазы с ростом температуры превращаются в формиатные соединения, которые разлагаются, давая продукты полного окисления — CO. CO2, и Н2О).
На МоО3, избирательном катализаторе процесса, при термодесорбции обнаружены два слабохемосорбированных состояния метанола (см. рис. -1), причем большая часть метанола десорбируется при температурах до 210°С. Хроматографически показано, что в области 60 – 210°С десорбируется обратимо хемосорбированный метанол, а при 210—310°С — формальдегид и вода.
При окислении адсорбированного метанола кислородом обе формы участвуют в образовании формальдегида. ИК-спектроскопически на Мо03 обнаружены только слабохемосорбированные соединения которым отвечают структуры с координационной (или водородной) связью и метоксильные структуры. Обе хемосорбированные формы участвуют в образовании формальдегида. Под действием кислорода газовой фазы они превращаются в поверхностные соединения типа альдегида, досорбирующегося с образованием формальдегида). Лишь малые количества метанола десорбируются до 250—280°C без разложения. Раздельным окислением форм показано, что следы формальдегида появляются при окислении слабохе-мосорбированного состояния, соответствующего структуре с координационной и (или) водородной связью и в малой степени метоксильным структурам. Метоксильные соединения при повышении температуры доокисляются кислородом поверхности до формиатов, причем это протекает при более мягких условиях на катализаторах со слабосвязанным кислородом. На МоО3, присутствует в основном слабохемосорбированный метанол, десорбирующийся до 300°С.
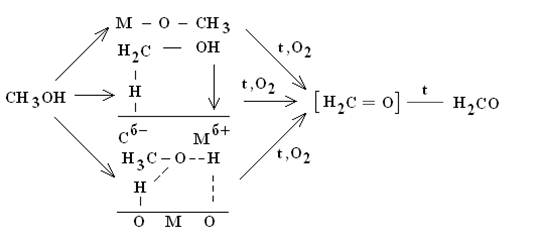
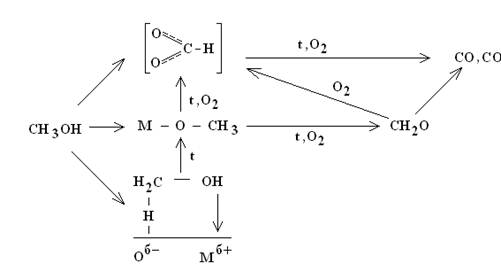
Выделяют следующие схемы механизма процесса окисления метанола:
|
на селективных окисных катализаторах.
на окисных катализаторах, направляющих процесс в сторону полного окисления:
|
Таким образом, поверхностные метоксильные группы могут в зависимости от прочности связи их с поверхностью и свойств кислорода поверхности контакта превращаться в продукты как полного, так и парциального окисления. Необходимые признаки катализаторов парциального окисления — отсутствие слабосвязанного кислорода на поверхности и небольшая прочность связи поверхностных метоксилов. Важным является и отсутствие процесса доокисленпя продукта реакции — формальдегида.
На МоО3, адсорбция формальдегида дает только структуры альдегидоподобного типа без деструкции, т. е. окислы, ведущие селективное окисление, способны десорбировать формальдегид в газовую фазу без доокисления.
Предложенные схемы механизмов подтверждаются и исследованиями бинарных окисных катализаторов.
В отличие от этих систем на высокоселективных катализаторах парциального окисления установлено наличие сильных бренстедовских кислотных центров, все они содержат катионы, дающие кислотообразующие окислы.
Действительно, наличие сильных бренстедовских кислотных центров характерно для MoO3, Fе—Mo, Si—Mo, Cr—Mo и Ti — Mo окисных катализаторов, являющихся катализаторами селективного окисления метанола. Интересно в связи с этим отметить увеличение концентрации бренстедовских кислотных центров для Fе—Мо окисного катализатора, наблюдающееся при увеличении содержания молибдена. Последнее, как известно, увеличивает и селективность катализатора. Хотя в настоящее время значение бренстедовской кислотности в окислении метанола до конца не выяснено, ясно, что она может играть существенную роль в процессе парциального окисления спирта.
Таким образом, целью данной работы является изучение процесса разложения метанола до формальдегида на нанесённых молибденсодержащих катализаторах. В качестве промотирующих добавок выбраны соединения калия и меди.
– Конец работы –
Эта тема принадлежит разделу:
Медь-калий-молибденсодержащие нанесённые катализаторы на основе оксида алюминия
На сайте allrefs.net читайте: "Медь-калий-молибденсодержащие нанесённые катализаторы на основе оксида алюминия"
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Литературный обзор
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов