рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Методика эксперимента
Реферат Курсовая Конспект
Методика эксперимента
Методика эксперимента - раздел Химия, Медь-калий-молибденсодержащие нанесённые катализаторы на основе оксида алюминия 4.1 Определение Каталитических Свойств Модельных Образцов В Реакции Разлож...
4.1 Определение каталитических свойств модельных образцов в реакции разложения метанолапроизводят на микрокаталитической установке в проточном режиме. Исходную газовую смесь(~4.5 об.% метанола в аргоне) получали путем насыщения аргона метанолом в сатураторе при 0 0С. В продуктах реакции с помощью катарометра и ионизационно-пламеного детектора регистрировались следующие вещества: диметиловый эфир, метилформиат, метан, водород, воду, моно- и диоксид углерода.
Микрокаталитический метод позволяет исследовать небольшие объемы катализатора в кинетическом режиме. Хроматографический анализ реакционной газовой смеси позволяет разделить и количественно определить состав и содержание продуктов реакции. Для контроля каталитических свойств используется катарометр, а для реакций, где выход целевого продукта при атмосферном давлении низок, необходима более высокая чувствительность достаточная для количественного определения органических соединений (спиртов, эфиров и т.д.). Поэтому в газовой схеме использовали пламенно-ионизационный детектор.
После прохождения реактора – 2, в котором поддерживается необходимая температура, не прореагировавшие исходные вещества и продукты реакций направляются в хроматографическую колонку – 6 для разделения смеси продуктов. При температуре адсорбента газы СО, СО2 и Н2 практически не удерживаются и поэтому, выходя из колонки разделения направляются в рабочую ячейку ДИП. после регистрации на приборе КСП сигналов от проходящих СО, СН4 и компонентов продуктов реакции, имеющих большое время удерживания в разделительной колонке, удаляются в атмосферу.
Для предотвращения конденсации компонентов газовой смеси в регулирующей аппаратуре и коммуникациях и сокращения размеров аппаратуры все регистрирующие узлы вместе с колонкой для разделения смеси компонентов помещены в термостат крана-дозатора – 1. Избыточное давление в системе определяется гидравлическим сопротивлением двух разделительных колонок и составляет ≈0,2 МПа [12].
.
|

4.2 Методика определения удельной поверхности и каталитической активности металлической меди.
Для определения поверхности металлической меди использовали 0,15-0,2 мм фракцию катализаторов массой 0.1 г. Восстановление катализаторов проводили в токе водорода при температуре восстановления 250°С.
Определение величины удельной поверхности меди основано на реакции разложения N2O:
2Cus + N2Ogas → Cu2O + N2,[22-26]
при этом на 2 атома меди приходится одна молекула N2. Для определения количества поверхностной меди реакция разложения N2О проводилась при 50-60°С.
Удельная поверхность меди может быть вычислена следующим образом:
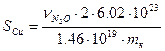 , где
, где
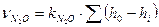 - количество прореагировавшей закиси азота, моль;
- количество прореагировавшей закиси азота, моль;
 - калибровочный коэффициент, моль/мм;
- калибровочный коэффициент, моль/мм;
h0 - высота хроматографического пика, соответствующая всей закиси азота, поданной на катализатор, мм;
hi - высота хроматографического пика, соответствующая непрореагировавшей части закиси азота, мм;
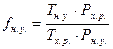 - фактор нормальных условий, где Тн.у. и Pн.у. – температура и давление при нормальных условиях, Тх.р. и Рх.р. - температура и давление при окислении меди;
- фактор нормальных условий, где Тн.у. и Pн.у. – температура и давление при нормальных условиях, Тх.р. и Рх.р. - температура и давление при окислении меди;
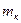 - масса катализатора загруженного в реактор, г;
- масса катализатора загруженного в реактор, г;
0.1 - объём петли в кране-дозаторе, мл.
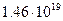 - поверхностная плотность атомов меди (среднее значение по граням Сu (100), (110) и (111))
- поверхностная плотность атомов меди (среднее значение по граням Сu (100), (110) и (111))
Определение удельной поверхности меди было проведено с применением импульсного метода с хроматографическим анализом. Реактор помещен в термостат, позволяющий вести активацию катализатора в широком интервале температур. Реактор включен в газовую схему через шестиходовой кран, что позволяет производить переход с импульсного режима работы на непрерывный для проведения предварительного восстановления катализатора водородом.
Расход газов устанавливали регуляторами потоков. В работе использовали N2О, гелий и водород. Пуск импульсов осуществляли с помощью петли шестиходового крана, в который подавался N2О. Анализ выходящего газа осуществляли хроматографическим методом с использованием детектора по теплопроводности на хроматографе. Ток детектора был равен 130 mA. Для разделения продуктов использовали колонку, заполненную силикогелем. Температура термостатирования колонки составляла 95°С.
Предварительно катализатор активировали в токе водорода при атмосферном давлении и температуре 250°С. Далее восстановленный катализатор охлаждали до комнатной температуры. После этого переходили к измерению количества поверхностной металлической меди в реакции разложения N2О. Из величины сигнала при выбранных значениях температуры с учетом чувствительности детектора рассчитывали текущую концентрацию продуктов реакции.
4.3 Определение концентрации формальдегида. В поглотительный сосуд наливаем определенный объем воды, пропускаем газ после реактора, содержащий формальдегид, в течение 30 минут, отбираем аликвоту на анализ, по полученным результатам находим содержание формальдегида в газе
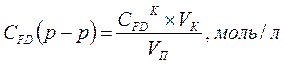
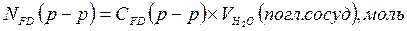
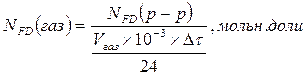
где
СFDК – концентрация формальдегида, найденная по калибровочному графику, моль/л
VK – объем колбы для разбавления, мл
VA – объем аликвоты, взятой на анализ, мл
Vгаз – расход газа, см3/мин
Δτ – время прохождения газа, мин
Построение калибровочного графика
В мерные колбы вместимостью 50 мл наливаем последовательно 0, 1, 2, 3, 4, 5, 6 мл стандартного раствора формальдегида (0,42 моль/л). Концентрацию формальдегида в стандартном растворе определяли йодометрическим методом, который основан на следующей реакции:
CH2O + I2 + OH– Þ HCOOH + 2I– + H+
К аликвотной части раствора добавляем йодистый калий и титруем выделившийся йод раствором тиосульфата натрия в присутствии крахмала до исчезновения синей окраски.
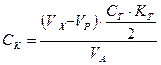
где
СК- концентрация меди в образце, масс.%;
VX- объем холостой пробы, мл;
VP- объем рабочей пробы, мл;
СТ- концентрация тиосульфата, моль/л;
КТ- коэффициент пересчета тиосульфата;
VA-объем аликвоты, взятой на анализ, мл.
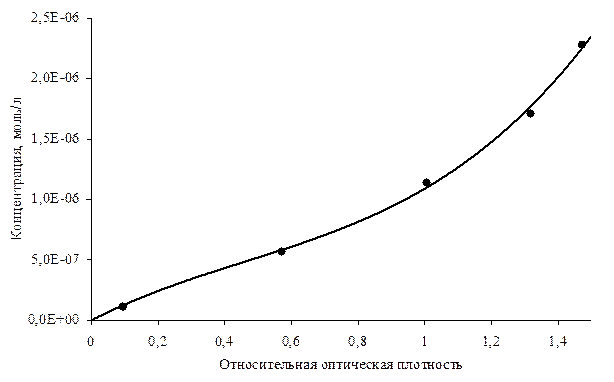
Рис 5. Зависимость оптической плотности от концентрации формальдегида.
Добавляем дистиллированной воды до половины объема колбы, приливаем 20 мл ацетилацетон аммиачного реагента, помещаем колбы в термостат и выдерживаем при температуре 40 °С в течении 10 минут. Затем охлаждаем колбы под струей воды, доводим объем растворов до меток дистиллированной водой, перемешиваем и измеряем оптическую плотность приготовленных растворов на фотоколориметре при длине волны 440 нм в кювете с толщиной слоя 50 мм.
Раствором сравнения служит первый раствор, не содержащий стандартного раствора формальдегида. По полученным данным строим калибровочный график: оптическая плотность – масса формальдегида.
Ацетилацетон аммиачный реагент готовим следующим образом: в мерной колбе на 1000 мл растворяем 150 г ацетата аммония в 800 мл дистиллированной воды. К раствору добавляем 2 мл ацетилацетона, 3 мл уксусной кислоты. Раствор перемешиваем до полного растворения, доводим дистиллированной водой до метки.
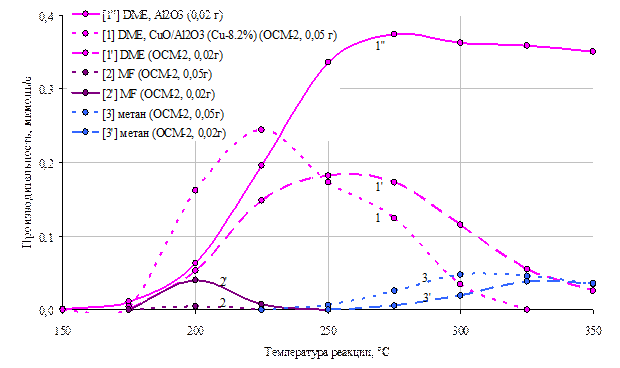
Рис 7. Зависимости производительности катализатора СuO/Al2O3 (Сu-8,2%) по диметиловому эфиру (1, 1’,1’’), метилформиату (2, 2’, 2’’) и метану (3, 3’, 3’’) от температуры.
1,2,3 – масса катализатора 0,05г
1’,2’,3’ – масса катализатора 0,02 г.
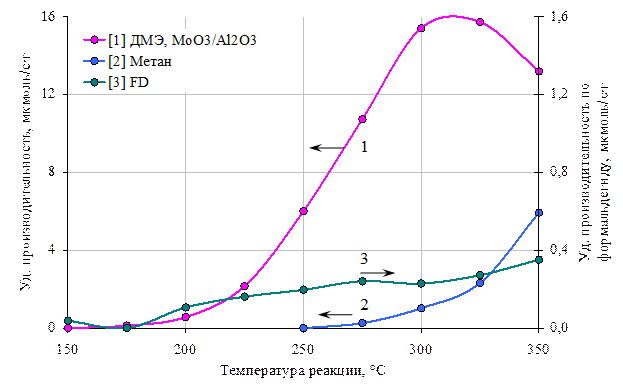
Рис 8. Зависимости производительности по диметиловому эфиру(1), метану(2) и формальдегиду (3) катализатора МоО3/Al2O3 9 (Мо-13,4%) от температуры.

Рис 9. Зависимости степени разложения (3, 3’, 3’’) и производительности по диметиловому эфиру (1, 1’,1’’) и метану (2, 2’, 2’’) катализаторов: 1- СuO/K2O/Al2O3 (Сu-7,9%, К-0,6%), 2- СuO/K2O/Al2O3 (Сu-9,3%, К-2,4%) и 3- СuO٠K2O/Al2O3(Сu-6,4%, К-0,4%) от температуры.
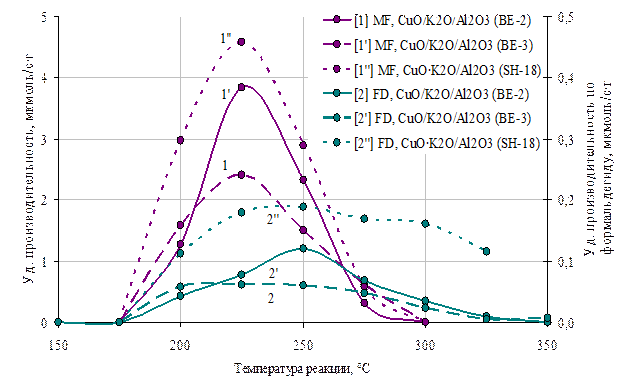
Рис 10 . Зависимости производительности по метилформиату(1, 1’,1’’) и формальдегиду (2, 2’, 2’’) катализаторов 1- СuO/K2O/Al2O3 (Сu-7,9%, К-0,6%), 2- СuO/K2O/Al2O3(Сu-9,3%, К-2,4%) и 3- СuO٠K2O/Al2O3(Сu-6,4%, К-0,4%) от температуры.
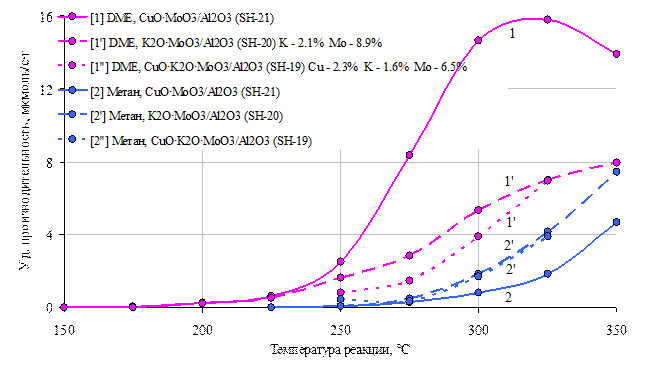
Рис 11. Зависимости производительности по диметиловому эфиру(1, 1’, 1’’) и метану(2, 2’, 2’’) катализаторов СuO٠MoO3/Al2O3 (Сu-1,8%, Mo-8,8%), K2O٠MoO3/Al2O3(K-2,0%, Mo – 8,8%) и CuO٠ K2O٠MoO3/Al2O3(Cu – 2,3%, K-0,5%, Mo-8,5%) от температуры.
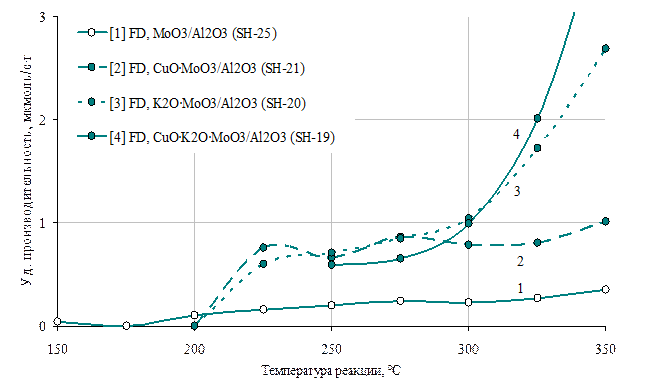
Рис 12. Зависимости производительности по формальдегиду катализаторов от температуры
1 - MoO3/Al2O3(Mо-11,9)
2 - CuO ٠MoO3/Al2O3(Сu-1,8%, Mo-8,8%)
3 - K2O٠MoO3/Al2O3(K-2,0%, Mo – 8,8%)
4 - CuO٠ K2O٠MoO3/Al2O3(Cu – 2,3%, K-0,5%, Mo-8,5%).
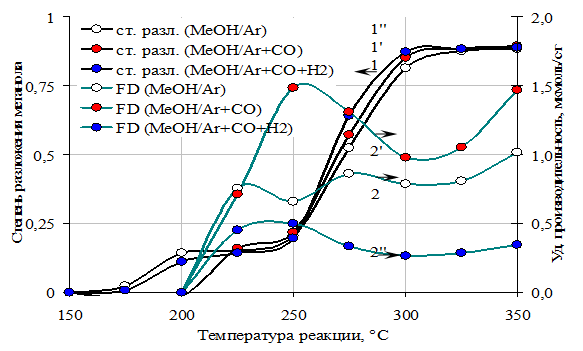
Рис 13. Зависимости степени разложения и производительности катализатора СuO٠MoO3/Al2O3 (Cu-1,8%, Mo-8,8%) по формальдегиду от температуры реакции в разных средах:
1, 2 – МеОН/(Ar)
1’, 2’ - МеОН/(Ar+CO)
1’’, 2’’ - МеОН/(Ar+CO+H2)
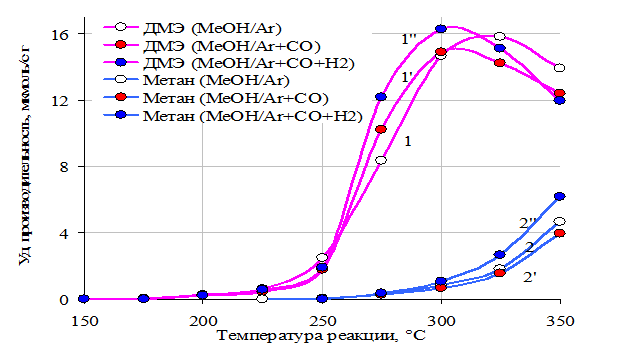
Рис 14. Зависимости производительности катализатора СuO٠MoO3/Al2O3 (Cu-1,8%, Mo-8,8%) по диметиловому эфиру и метану от температуры реакции в разных средах:
1, 2 – МеОН/(Ar)
1’, 2’ - МеОН/(Ar+CO)
1’’, 2’’ - МеОН/(Ar+CO+H2)
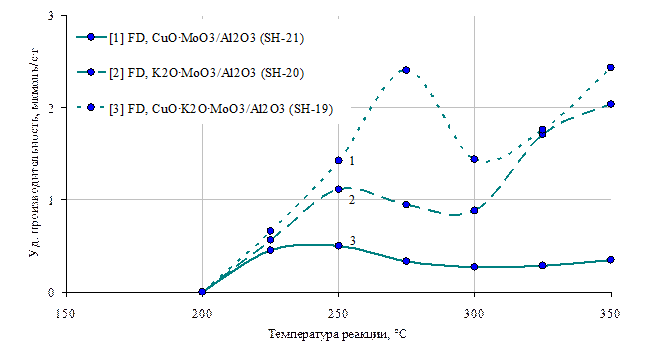
Рис 15. Зависимости производительности по формальдегиду от температуры реакции катализаторов: 1- CuO ٠MoO3/Al2O3(Сu-1,8%, Mo-8,8%), 2- K2O٠MoO3/Al2O3(K-2,0%, Mo – 8,8%), 3- CuO٠ K2O٠MoO3/Al2O3(Cu – 2,3%, K-0,5%, Mo-8,5%).

Рис.16. Зависимости производительности катализатора CuO٠ K2O٠MoO3/Al2O3(Cu – 2,3%, K-0,5%, Mo-8,5%) по диметиловому эфиру, метану и формальдегиду от температуры реакции в разных средах:
1, 2, 3- МеОН/(Ar)
1’, 2’,3’ - МеОН/(Ar+ H2)
При разложении метанола на γ-Al2O3 в основном идет реакция дегидратации метанола с образованием диметилового эфира (DME). Данная реакция является экзотермической, поэтому с увеличением температуры процесса (выше 250 °С) состав реакционной среды приближается к равновесному, и концентрация DME постепенно снижается (рис.7 кривая 1’’).
После нанесения на оксид алюминия некоторого количества меди (образец - CuO/Al2O3) наряду с диметиловым эфиром образуется метилформиат (MF), метан и другие лёгкие газы (СО, СО2, Н2) (рис.7 кривые 2,2’,3,3’). Медный компонент также проявляет каталитическую активность относительно образования диметилового эфира, повышая скорость по данному маршруту при относительно низких температурах (175-225 °С) (рис.7 кривая 1). С увеличением времени контакта газовой смеси с катализатором становится более протекание последовательных реакций с разложением диметилового эфира и метилформиата. Это показано в экспериментах с изменением объема загрузки катализатора, а именно, с увеличением массы образца при высоких температурах количество целевых веществ (DME и MF) уменьшается. (рис. 7) и увеличивается количество продуктов разложения (метан, кривые 3 и 3’), а так же СО, СО2 и Н2 которые так же связаны маршрутом паровой конверсии СО.
Разложение метанола на исследованных катализаторах можно представить следующими уравнениями химических реакций:
2CH3OH Þ CH3OCH3 + H2O, DME
2CH3OH Þ CH3OCH2O + 2H2, MF
CH3OH Þ CO + 2H2
CH3OCH2O Þ CH2O + CO + H2, FD
CH3OCH3 Þ CH4 + CO + H2,
CH3OH Þ CH2O + H2,
CO + H2O Û CO2 + H2.
Молибденсодержащие системы известны как катализаторы парциального окисления метанола до формальдегида [1,2], поэтому и в наших исследованиях мы опробовали данный элемент с целью усиления функции образования FD. Оказалось, что катализатор МоО3/Al2O3 так же активен в реакции разложения метанола до диметилового эфира, но по сравнению с медьсодержащим при более высоких температурах (рис 8). В связи с тем, что присутствие в продуктах реакции формальдегида, в отличие от метана, наблюдалось в более широком диапазоне температур, можно предположить, что образование FD происходит по отдельному маршруту (рис 8).
Следующим этапом исследования является изучение медькалиевых систем относительно образования формальдегида, т.к. в дальшейшем предполагается использовать данные элементы в качестве модифицирующих добавок к молибденовым катализаторам.
При приготовлении катализаторов калий часто используется для увеличения основности поверхности. Введение оксида калия в медьсодержащие системы приводит к формированию на поверхности более сложных активных центров и изменению соотношения количества промежуточных частиц, в качестве которых рассматриваются метиловые, формильные и формиатные группировки.

| Метильные группы |
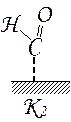
| Формильные группы |

| Формиатные группы |
Добавка калия не только изменяет основность поверхности, но и дисперсную структуру медного компонента. В экспериментах по адсорбции закиси азота определили удельную поверхность медного компонента целого ряда катализаторов.
Таблица 2
Площадь поверхности медного компонента модельных катализаторов
| Наименование | Тип катализатора | Содержание, масс.% | Площадь поверхности медного компонента, м2/гк | |
| Cu | К | |||
| BE-2 | CuO/K2O/Al2O3 | 7.9 | 0.6 | 4.0 |
| SH-18 | CuO×K2O/Al2O3 | 6.4 | 0.4 | 2.5 |
| BE-3 | CuO/K2O/Al2O3 | 9.3 | 2.4 | 1.5 |
| ОСМ-1 | CuO/Al2O3 | 4.9 | - | 3.9 |
| ОСМ-2 | CuO/Al2O3 | 8.2 | - | 4.7 |
Из таблицы видно, что добавка соединений калия в медьсодержащие катализаторы в целом снижает площадь её поверхности.
В связи с тем, что увеличение производительности медь-калиевых катализаторов по метилформиату происходит одновременно с формальдегидом, можно предположить, что их образование происходит на одних и тех же активных центрах (рис 10). Следует отметить, что наиболее активным по метилформиату и формальдегиду, среди серии образцов, является катализатор с наименьшим содержанием меди и калия, обладая при этом средней удельной площадью медной поверхности. По-видимому, при совместном нанесении соединений меди и калия достигается лучшее распределение данных компонентов, что способствует формированию сложного активного центра, обеспечивающего образование промежуточных группировок, участвующих в синтезе как метилформиата так и формальдегида.
В ряду медь-калиевых катализаторов с уменьшением удельной площади медной поверхности наблюдается увеличение удельной производительности по диметиловому эфиру и снижение по метану при относительно высоких температурах (300-350°С) (рис 9). Такое изменение соотношения продуктов реакции, по-видимому, связано со скоростью разложения диметилового эфира до метана на медном компоненте катализатора. Т.е. чем больше площадь медной поверхности, тем больше скорость разложения диметилового эфира при относительно высоких температурах (300-350°С).
Далее, с целью увеличения селективности и производительности катализатора по формальдегиду, мы постепенно усложнили структуру его активной поверхности путем введения в молибденсодержащую систему соединений меди и калия. Оказалось, что принципиально удается увеличить производительность катализатора более сложного состава в широком температурном диапазоне (рис 12). Как соединения калия, в довольно узком диапазоне концентраций, так и соединения меди увеличивают производительность молибденовых катализаторов при относительно низких температурах реакции (около 250 °С). При относительно высоких температурах (325-350 °С) концентрация формальдегида на калий-молибденовом образце выше, чем на медь-молибденовом, а совместное присутствие меди и калия в молибденовом катализаторе позволяет наиболее сильно увеличить производительность в данном диапазоне температур (рис.12). Следует отметить, что при наличии Cu в катализаторе значительно подрастает производительность по ДМЕ, что нежелательно, если целевым продуктом является FD. Поэтому здесь следует найти оптимальное соотношение данных компонентов (рис 11).
Метанол получают из синтез – газа, т.е. смеси оксида углерода и водорода на медьсодержащих катализаторах при высоких давлениях (5-10 МПа) и температурах около 200-280 °С. Метанол используют как сырье для получения более сложных углеводородов уксусной кислоты, метилформиата и формальдегида. Поскольку получение формальдегида, в дальнейшем, предполагается проводить в одном реакторе из синтез-газа через стадию образования метанола, то мы так же изучили влияние состава реакционной газовой среды на селективность молибденсодержащих катализаторов.
Повышенное парциальное давление монооксида углерода на молибденовых образцах, промотированных соединениями калия и меди, увеличивает удельную производительность по формальдегиду, особенно сильно при 225 °С, а среда, содержащая водород, - снижает (рис 13). При этом производительность по диметиловому эфиру, метану и степень разложения метанола практически не изменяется (рис 14). Этот факт свидетельствует о том, что монооксид углерода адсорбируется на поверхности катализатора и участвует в образовании формальдегида совместно с группировками, образующимися из метанола. Водород, по-видимому, замедляет переход от метокси к формиатным группам, так как этот процесс предполагает отщепление водорода.
CO(г) Û CO(адс);
CO(адс) + HO-(адс) Û HCOO-(адс);
HCOO-(адс) + H (адс) Û CH2O(адс) + HO-(адс);
CH3OH(г) + O-(адс) Û CH3O(адс) + HO-(адс);
CH3O(адс) + O-(адс) Û CH2O(адс) + HO-(адс);
CH2O(адс) Û CH2O(г).
На этих же образцах наблюдается максимум последующим минимумом (рис 13) удельной производительности по формальдегиду, что указывает на то, что при относительно низких температурах формальдегид преимущественно образуется на медном или калиевом компоненте катализатора, а при относительно высоких – на молибденовом. Сохранение, а также усиление положительных свойств отдельных компонентов в сильно восстановительной среде наблюдается на наиболее сложном катализаторе CuO×K2O×MoO3/Al2O3 из серии изученных образцов, что сказывается в достаточно высокой концентрации формальдегида на выходе из реактора в широком диапазоне температур.
– Конец работы –
Эта тема принадлежит разделу:
Медь-калий-молибденсодержащие нанесённые катализаторы на основе оксида алюминия
На сайте allrefs.net читайте: "Медь-калий-молибденсодержащие нанесённые катализаторы на основе оксида алюминия"
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Методика эксперимента
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов