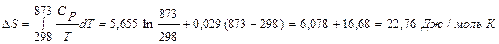Методы расчета изменения энтропии
Уравнения (II, 12) и (II, 13), определяющие энтропию, являются единственными исходными уравнениями для термодинамического расчета изменения энтропии системы. Заменяя элементарную теплоту в уравнении (II, 13) её выражениями через калорические коэффициенты (см. уравнения (I, 29) и (I, 35)), получаем для равновесных процессов:
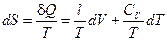 (II, 20)
(II, 20)
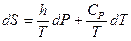 (II, 21)
(II, 21)
Уравнения (II, 20) и (II, 21) являются полными дифференциалами энтропии как функции переменных V, Т или P, Т. Коэффициенты этих уравнений — частные производные энтропии по соответствующим переменным.
Подставив в уравнение (II, 20) значения калорических коэффициентов для одного моля идеального газа: l = P = RT/V (уравнение (I, 40)) и h = –V = –RT/P (уравнение (I, 42)) и полагая СV и СP независимыми от температуры (что допустимо лишь в небольших температурных интервалах), получим после интегрирования в известных пределах:
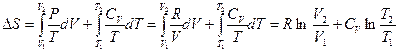 (II, 22)
(II, 22)
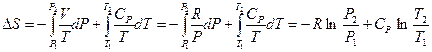 (II, 23)
(II, 23)
Применим полученные выше соотношения для расчетов изменения энтропии при некоторых процессах:
1. Фазовые превращения (изотермические процессы; Т = const):
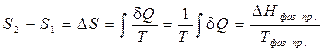 (II, 24)
(II, 24)
Так, например, теплота плавления бензола равна 9,764 кДж/моль; температура плавления tпл. = 5,5°С (Т = 278,5 К). Следовательно, изменение энтропии 1 моль бензола при плавлении (энтропия плавления) равно:
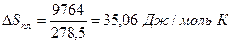
2. Нагревание при постоянном давлении (изобарный процесс; P = const). Из уравнений (I, 16) и (II, 13) получаем:
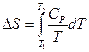 (II, 25)
(II, 25)
Найдем изменение энтропии одного моля алюминия при нагревании от 25 до 600°С. Истинная мольная теплоемкость алюминия может быть выражена уравнением:
Ср= 5,655 + 0,029 Т. По уравнению (II, 6) изменение энтропии будет равно: