Абсолютные значения энтропии
Постулат Планка используется при термодинамическом исследовании химических процессов для вычисления абсолютных значений энтропии химических соединений — величин, которые имеют большое значение при расчете химических равновесий.
Энтропия твердого вещества вычисляется по уравнению (II, 27):
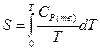 (II, 28)
(II, 28)
Для вычисления необходимо знать экспериментальные значения теплоемкости, определенные до возможно более низких температур. Значение теплоемкости до 0 К находят путем экстраполяции по уравнению Дебая, либо с помощью эмпирических приемов. Если минимальную температуру, при которой определено значение теплоемкости, обозначить Т*, то можно определить значение коэффициента a’ в уравнении Дебая, приравняв выражение для теплоемкости твердого тела по закону Т — кубов и выражение для теплоемкости в виде степенной функции (I, 17), считая, что при Т* они равны:
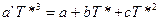
Принимая во внимание, что в приведенном уравнении известны все величины, кроме коэффициента a’, его легко определить. Тогда интеграл (II, 27) можно разложить на два:
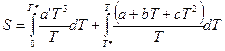
При переходе в жидкое состояние при нормальной температуре плавления энтропия возрастает на величину приведенной теплоты плавления. Нагреванию жидкости отвечает увеличение энтропии, вычисляемое по уравнению (II, 27), причем в подынтегральную функцию входит теплоемкость жидкости:
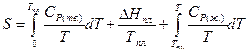 (II, 29)
(II, 29)
Испарению жидкости при постоянном давлении (например, при Р = 760 мм рт. ст.) и нагреванию газа соответствует увеличение энтропии, аналогично тому, как это имеет место при плавлении твердого тела и нагревании жидкости. Таким образом, уравнение для вычисления энтропии газа при некоторой температуре Т будет иметь вид:
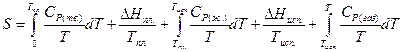 (II, 30)
(II, 30)
По этому уравнению можно вычислить энтропию идеального газа при температуре Т и 1 атм (если испарение проводилось при нормальной температуре кипения).
В том случае, когда вещество в твердом состоянии имеет не одну, а две или более модификации, в правой части уравнения (II, 28) добавятся соответствующие члены — прирост энтропии при переходе первой модификации во вторую, прирост энтропии при нагревании второй модификации и т. д.
Интегральные члены уравнений (II, 28), (II, 29) и (II, 30) можно найти графически. Для этого строят кривые СР/Т=φ(Т) или СР=φ(lnТ) и численное значение интеграла определяют по величине площади, ограниченной кривыми и осью абсцисс, заключенными между соответствующими температурами.
Величина энтропии сложным образом отражает всю совокупность свойств соединения в данном его агрегатном состоянии. Энтропия веществ зависит от молекулярной массы (увеличивается с ее ростом в ряду близких по свойствам веществ), от агрегатного состояния веществ (возрастает при переходе от твердых тел к жидким и особенно к газообразным), а также от кристаллического строения, изотопного состава и структуры молекул.