Общие условия равновесия
Любая закрытая система, находящаяся в равновесии при постоянных давлении и температуре, характеризуется соотношением: 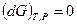
Для системы переменного состава (смотри (III, 58)):
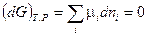 (IV, 11)
(IV, 11)
Если при постоянных Р и Т из фазы 1 в фазу 2 переходит 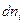 молей i-ого компонента, то
молей i-ого компонента, то
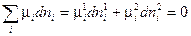 (IV, 12),
(IV, 12),
где верхний индекс относится к фазе, а нижний индекс — к компоненту.
При переходе dni молей i-ого компонента из фазы 1 в фазу 2 его количество в одной из фаз убывает, а в другой фазе увеличивается на ту же самую величину, следовательно, 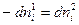 . Тогда уравнение (IV, 12) можно записать в следующем виде:
. Тогда уравнение (IV, 12) можно записать в следующем виде:
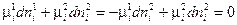
или 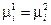 (IV, 13)
(IV, 13)
Таким образом, химический потенциал i-ого компонента в фазе 1 равен химическому потенциалу в фазе 2.
Обобщая этот результат на все фазы и все компоненты гетерогенной системы, получим условие равновесия:
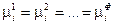 (IV, 14),
(IV, 14),
где Ф — число фаз.
Таким образом, гетерогенная система будет находиться в состоянии равновесия при выполнении равенств (IV, 14) и ряда тождеств:
T1 = T2 = ... = TФ = T
P1 = P2 = ... = PФ = P
Покажем, что равенство интенсивных переменных — температур, давлений и химических потенциалов компонентов есть также условие равновесия в изолированных системах, что непосредственно вытекает из второго закона термодинамики.
Воспользуемся обобщенной формой записи первого и второго законов термодинамики (смотри (III, 63)):
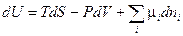
Перепишем это уравнение относительно dS :
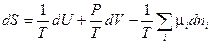 (IV, 15)
(IV, 15)
Из этого уравнения следует, что частные производные энтропии по экстенсивным переменным U,V и ni выражаются через интенсивные свойства системы Т, Р и mi:
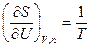 (IV, 16)
(IV, 16)
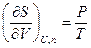
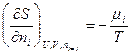
Рассмотрим изолированную систему, состоящую из двух подсистем «А» и «В», открытых по отношению друг к другу (смотри рис.14).
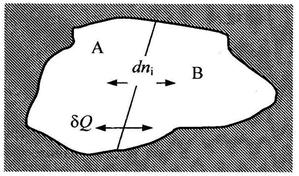
Рис. 14. Изолированная система, состоящая из двух подсистем, открытых по отношению друг к другу.
Эти подсистемы способны обмениваться энергией и веществом, но оболочка, ограничивающая систему в целом, остается несжимаемой и исключает теплообмен. Внутренняя энергия, энтропия, объем и количества компонентов — функции экстенсивные. Поэтому для изолированной системы, состоящей из «А» и «В», справедливы следующие соотношения:
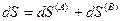 (IV, 17)
(IV, 17)
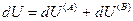
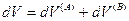
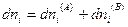
и поскольку U,V и n всей системы имеют постоянные значения (изолированная система), то
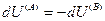 (IV, 18)
(IV, 18)
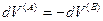
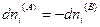
Энтропия — внутреннее свойство термодинамической системы; согласно постулатам термодинамики, при равновесии она является функцией внутренней энергии и внешних переменных.
Если в качестве внешних переменных для каждой из подсистем «А» и «В» выбрать их объем и количества веществ, то полный дифференциал функции S = S(U,V,n) для каждой из подсистем запишется в виде (IV, 15), а частные производные будут выражены формулами (IV, 16).
С учетом этого и соотношений (IV, 18) общее изменение энтропии изолированной системы запишется следующим образом:
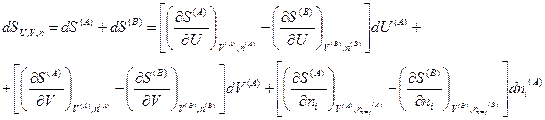
Согласно второму закону термодинамики, при равновесии энтропия изолированной системы достигает максимума, т. е. dSU,V,n = 0. Изменения dUA, dVA и 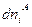 являются независимыми, поэтому равенство нулю dSU,V,n возможно только в том случае, если равен нулю каждый из коэффициентов, стоящих в квадратных скобках, т. е.
являются независимыми, поэтому равенство нулю dSU,V,n возможно только в том случае, если равен нулю каждый из коэффициентов, стоящих в квадратных скобках, т. е.
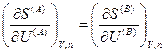
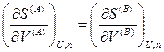
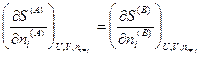
Если теперь принять во внимание выражения для частных производных энтропии (смотри (IV, 16)), то получим следующие соотношения:
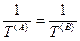
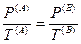
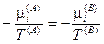
Из последних трех уравнений очевидным образом следуют общие условия равновесия изолированной термодинамической системы:
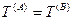 — термическое равновесие,
— термическое равновесие,
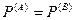 — механическое равновесие,
— механическое равновесие,
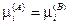 — химическое равновесие.
— химическое равновесие.
Если хотя бы некоторые из этих условий не выполняются, то система является неравновесной и в ней могут происходить процессы, сопровождающиеся выравниванием соответствующих интенсивных параметров.