Тепловая теорема Нернста
Прямой и простой расчет изменения энергии Гиббса, а, следовательно, и констант равновесия химических реакций не вызывает затруднений, если известны теплота химической реакции и абсолютные значения энтропии всех участников реакции. Постулат Планка дает такую возможность, т. е. возможность вычисления абсолютных значений энтропии индивидуальных веществ при любой температуре.
Тепловая теорема Нернста исторически предшествовала названному постулату и относится к тому периоду в развитии термодинамики, когда решение задачи об определении изменения энергии Гиббса реакции было связано с определенными трудностями.
Для расчета DG реакции — главной цели учения о химическом равновесии — требовались опытные определения:
– теплового эффекта реакции при какой-нибудь одной температуре
– теплоёмкостей в широком интервале температур
– констант равновесия при разных температурах для того, чтобы определить значение константы интегрирования I в уравнении Гиббса-Гельмгольца.
Получаемое в конечном результате уравнение DG = ¦(T) могло быть применимо в тех пределах температур, в которых определены теплоемкости и константы равновесия. Описанный нами путь являлся безукоризненным с опытной точки зрения; точность конечных расчетов полностью зависела от точности опытных данных. Очевидно, что весь этот путь являлся сугубо эмпирическим и притом очень трудоемким.
Нернст отчетливо поставил цель облегчить его теоретическими моментами. Рассуждения сводилась к следующему. Для вычисления DG химической реакции надо:
– опытным путем определить тепловой эффект реакции при какой-нибудь одной температуре
– опытным путем определить теплоёмкости в широком интервале температур
– создать теорию теплоёмкости для того, чтобы избежать эмпирических формул зависимости теплоёмкостей от температуры
– вывести уравнение для вычисления DG химической реакции непосредственно из уравнения Гиббса-Гельмгольца, совершенно не прибегая к опытным определениям констант равновесия.
Создать теорию теплоёмкости, которая бы количественно отображала действительные соотношения, не удалось.
Тем не менее, мысль Нернста вывести уравнение для DG химической реакции непосредственно из уравнения Гиббса-Гельмгольца
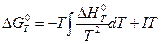 (V, 15)
(V, 15)
представляла особый интерес.
Очевидно, что для вычисления DG по этой формуле надо знать кроме зависимости DH от Т, по меньшей мере значение DG при какой-либо одной температуре, чтобы определить константу интегрирования I. Наличие этой неопределенности в качестве решения уравнения (V, 15) дает семейство кривых (смотри рис.21, на котором это семейство кривых обозначено пунктирными линиями).
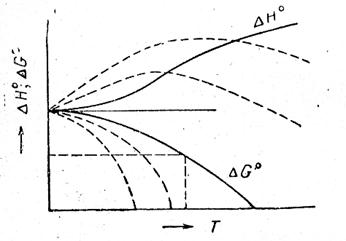
Рис. 21. Зависимость теплового эффекта и изменения энергии Гиббса химической реакции от температуры.
Причем, только одна из кривых является истинной (на рис. 21 она обозначена сплошной линией), т. к. энергия Гиббса — однозначная функция параметров состояния системы.
Руководствуясь рядом опытных указаний, Нернст высказал следующую гипотезу, получившую название тепловой теоремы Нернста: вблизи абсолютного нуля для конденсированных систем не только
DG0 = DH0, но и
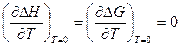 (V, 16)
(V, 16)
Графически это означает, что кривые DG и DH при абсолютном нуле соприкасаются, т. е. имеют общую касательную, причем эта касательная параллельна оси абсцисс (температур). Следовательно, из всего семейства кривых DG = ¦(T) реальной является та кривая, касательная которой при Т = 0 горизонтальна.
Если мы, как и раньше, представим DH в виде
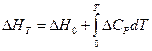
где DCP — разность теплоёмкостей продуктов реакции и исходных веществ, находящихся в конденсированном состоянии, то после подстановки в уравнение (V, 14) получим:
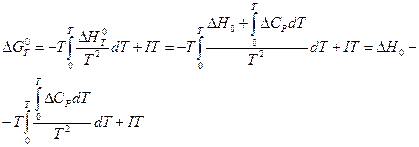 (V, 17)
(V, 17)
Берем теперь производную DG по Т, причем средний член справа в (V, 17) дифференцируем как произведение:
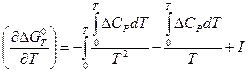 (V, 18)
(V, 18)
(при дифференцировании 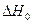 обращается в нуль, т. к. является константой и не зависит от температуры).
обращается в нуль, т. к. является константой и не зависит от температуры).
При переходе к пределу T ® 0 учитывается тот факт, что CP, а значит и DCP пропорциональны T3 по закону Т-кубов Дебая (смотри (I, 22)). Тогда при приближении к T = 0 оба первых члена в правой стороне уравнения (V, 18) обращаются в нуль. С учетом (V, 16) получаем:
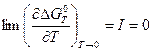
Следовательно, при температурах, близких к абсолютному нулю, константа интегрирования I в уравнении Гиббса-Гельмгольца также обращается в нуль.
Таким образом, для реакций в конденсированных системах в области абсолютного нуля уравнение (V, 17) переходит в уравнение:
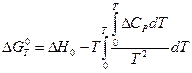
Опираясь на тепловую теорему Нернста, был сделан ряд важных и интересных заключений относительно энтропии твердых тел.
Т. к. в соответствии с (III, 32)
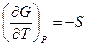 и
и 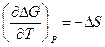 ,
,
то при Т = 0 
иными словами, процессы, протекающие в системе при абсолютно нуле, не изменяют её энтропии.
Планк расширил этот вывод, допустив, что энтропия всякого однородного кристаллического вещества равна нулю, т. е.
ST=0 = S0 = 0
Теорему Нернста в сочетании с гипотезой Планка, касающейся значения энтропии в нулевой точке, принято называть третьим законом (началом) термодинамики (смотри § 4 второй главы).