Зависимость энтальпии веществ и тепловых эффектов химических реакций от давления
При рассмотрении зависимости энтальпии от давления воспользуемся хорошо нам известным выражением ее полного дифференциала (III, 27):
dH = VdP + TdS
Разделим его на dP при условии постоянства температуры
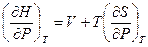 (V, 29)
(V, 29)
Теперь, если принять во внимание соотношение Максвелла (III, 38), согласно которому 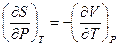 и подставить его в (V, 29), то получим:
и подставить его в (V, 29), то получим:
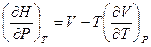 (V, 30)
(V, 30)
Если обе части последнего уравнения умножить на dP и проинтегрировать от Р = 1 атм. до Р при T = const, то это позволит определить абсолютную энтальпию вещества
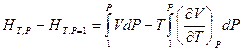 или
или 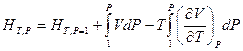
Аналогичное выражение можно записать для теплового эффекта химической реакции:
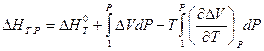
где 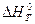 — тепловой эффект химической реакции при стандартных условиях, а DV — изменение объема системы в результате реакции.
— тепловой эффект химической реакции при стандартных условиях, а DV — изменение объема системы в результате реакции.
Теплоту реакции при любом давлении можно вычислить из полученного уравнения, если экспериментальные данные позволяют вычислить интегралы в его правой части.
Однако на практике поступают иначе. Запишем выражение для коэффициента сжимаемости: 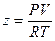 .
.
После дифференцирования z по температуре T при постоянном давлении (P = const) получаем:
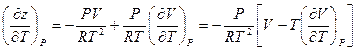
Или после очевидных преобразований:
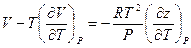
Если теперь полученное выражение подставить вместо правой части уравнения (V, 30), то окончательно имеем:
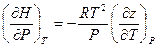 (V, 31)
(V, 31)
Принимая во внимание, что T=Tкрит. ´ t и P=Pкрит. ´ p (так как 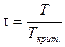 и
и 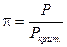 ), соотношение (V, 31) можно выразить через приведенные температуру и давление:
), соотношение (V, 31) можно выразить через приведенные температуру и давление:
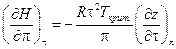
Интегрирование последнего уравнения от стандартного состояния до состояния при любом давлении после простых преобразований дает следующий результат:
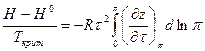 (V, 32)
(V, 32)
Решение уравнения (V, 32) дается в виде графиков или таблиц. Функция 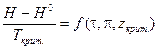 зависит от приведенных температуры, давления и zкрит.. Её значение позволяет учесть изменение энтальпии с изменением давления, а затем рассчитать тепловой эффект химической реакции при заданных условиях по уравнению:
зависит от приведенных температуры, давления и zкрит.. Её значение позволяет учесть изменение энтальпии с изменением давления, а затем рассчитать тепловой эффект химической реакции при заданных условиях по уравнению:
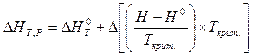
[1]Все сказанное выше относительно испарения действительно и для процесса возгонки (сублимации).