Дисциплина «ФИЗИЧЕСКАЯ ХИМИЯ»
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ
РОССИЙСКОЙ ФЕДЕРАЦИИ
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ
ГОУ ВПО Череповецкий государственный университет
Факультет ОМ и ЕНД
Кафедра химии
Дисциплина «ФИЗИЧЕСКАЯ ХИМИЯ»
МЕТОДИЧЕСКИЕ УКАЗАНИЯ К ЛАБОРАТОРНОЙ РАБОТЕ № 9
ИЗУЧЕНИЕ ФАЗОВОГО РАВНОВЕСИЯ В ДВУХКОМПОНЕНТНЫХ СИСТЕМАХ МЕТОДОМ ТЕРМИЧЕСКОГО АНАЛИЗА
Составитель: к.х.н., доцент Котенко Г.А.
г. Череповец – 2006 г.
Цель работы:Формирование навыков термического анализа систем с низкими температурами плавления и навыков построения диаграмм состояния двойных систем, компоненты которах практически нерастворимы друг в друге в твердои состоянии.
Теоретическая часть
Равновесия в гетерогенных системах, в которых не происходит химического взаимодействия между компонентами, а протекают лишь процессы перехода компонентов из одной фазы в другую ( или в другие), называются фазовыми равновесиями. Любая гетерогенная система характеризуется определенным числом фаз, компонентов и числом степеней свободы.
Фаза – часть гетерогенной системы, ограниченная поверхностью раздела и характеризующаяся одинаковыми физическими свойствами во всех своих точках. Фаза может быть раздроблена на отдельные части, но это не увеличивает числа фаз в системе. Например, в насыщенном растворе хлорида натрия в присутствии любого количества кристаллов соли и пара над раствором будут одна кристаллическая, одна жидкая и одна парообразная фазы. Система, содержащая более одной фазы, называется гетерогенной.
Число составных частей – это число тех видов частиц, составляющих систему, которые могут существовать отдельно и вне системы. Так, в водном растворе хлорида натрия будет содержаться много видов частиц (молекулы соли и воды, гидратированные ионы Na+, Cl-, H+). В действительности же в системе только две составные части: вода и поваренная соль, так как ни один из перечисленных ионов не может быть извлечен из данной системы в отдельности.
Независимые компоненты – это вещества, наименьшее число которых необходимо и достаточно для образования всех возможных фаз данной системы, находящейся в равновесном состоянии.
Термодинамические степени свободы – это независимые термодинамические параметры фаз системы, находящейся в равновесии, изменение которых в определяемых пределах не вызывает изчезновения одних и образования других фаз. К этим параметрам относятся температура, давление и концентрация вещества.
Вариантность системы – это число степеней свободы равновесной термодинамической системы. Из какого бы числа компонентов и фаз ни состояла гетерогенная система, условием равновесия между фазами в ней является то, что химический потенциал любого компонента должен быть одинаковым во всех фазах системы при постоянных температуре и давлении. Условия равновесия гетерогенной системы подчиняются правилу Гиббса. Уравнение правила Гиббса устанавливает зависимость между числом степеней свободы, числом компонентов и числом фаз в данной равновесной системе: С = К – Ф + 2,
где С – число степеней свободы; Ф – число фаз; К – число компонентов. Так как С 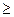 0, то Ф
0, то Ф  К + 2. Так в системе Н2О(ж) = Н2О(г)
К + 2. Так в системе Н2О(ж) = Н2О(г)
С = 1 - 2 + 2 = 1.
Рассмотрим равновесие в системе «жидкость–кристаллическая фаза». При кристаллизации жидких систем могут выделяться как чистые компоненты и образуемые ими химические соединения, так и твердые растворы на основе чистых компонентов и их соединений. В зависимости от того, какая фаза выделяется из раствора, двухкомпонентные системы с ограниченной взаимной растворимостью компонентов в жидком состоянии могут быть разделены на следующие типы: 1) без химических соединений и твердых растворов; 2) с образованием устойчивого химического соединения
(плавящегося конгруэнтно); 3) с образованием неустойчивого химического соединения (плавящегося инконгруэнтно); 4) с неограниченной растворимостью компонентов в твердом состоянии; 5) с ограниченной растворимостью компонентов в твердом состоянии.
К методам, применяемым для постороения диаграмм состояния, относятся методы растворимости, термического анализа, определения микроструктуры, рентгено-, электроно- и нейтронографии. Метод термического анализа является способом установления температур при равновесии между жидкими и твердыми фазами, который не требует ни механического разделения, ни химического анализа. Методы термического анализа в основном различаются способами регистрации температурных изменений, соответствующих фазовым переходам. Основные способы:
1) визуальный, при котором отмечается температура появления (или исчезновения) кристаллов в прозрачном растворе; 2) построение кривых охлаждения (или нагревания).
В способе построения кривых через небольшие промежутки времени измеряют с помощью термопары температуру непрерывно охлаждающейся (или нагревающейся) системы. Результаты измерений представлют графически, откладывая по оси абсцисс время, а по оси ординат – температуру. Если при непрерывном изменении температуры система не претерпевает никаких фазовых превращений, сопровождающихся выделением или поглощением теплоты, то ее температура является непрерывной фунцией времени. Поэтому зависимость температуры системы от времени изображается непрерывной кривой (Рис.1). Если же при охлаждении (нагревании) в системе происходят какие-либо превращения, например, выпадение твердой фазы из жидкости, переход одной полиморфной модификации в другую, то теплота, выделяющаяся (поглощающаяся) при превращении, изменяет скорость падения (роста) температуры системы, что выражается изменением углового коэффициента кривой «температура – время». Поэтому в промежутки времени, отвечающие температурам фазовых превращений, на кривых «температура–время» появляются изломы или горизонтальные участки, которые позволяют определять температуры превращений, не видя и не выделяя фаз, образующихся или исчезающих при охлаждении (нагревании) системы.
t0C

Рис.1 Кривые охлаждения:
1- при отсутствии фазовых превращений; 2 – кристаллизация при постоянной температуре; 3,4 – кристаллизация в температурном интервале;
5 – кристаллизация с переохлаждением
Если какое-либо чистое вещество (металл, соль, органическое соединение) нагреть до температуры в точке α, лежащей выше точки его плавления, а затем записать кривую охлаждения, то вначале падение температуры от времени будет выражаться плавной кривой αb (кривая 2). В некоторый момент времени t1 в точке b понижение температуры прекратится. На кривой появится горизонтальный участок bc. Это указывает на то, что в системе происходит процесс сопровождающийся выделением теплоты. На горизонтальном участке bc скорость охлаждения становится равной нулю и сохраняет это значение до времени t2, начиная с которого кривая плавно идет вниз до температуры в точке d, при которой запись кривой охлаждения прекращается. Появление горизонтального участка bc объясняется тем, что происходит переход вещества из жидкого состояния в твердое. Выделяющаяся при этом теплота кристаллизации возмещает потерю теплоты в окружающую среду, вследствие чего до окончания затвердевания температура держится на одном уровне. Из правила фаз Гиббса следует, что при постоянном давлении чистое вещество, распределенное между двумя фазами (твердой и жидкой), не имеет ни одной степени свободы, т.е. кристаллизация протекает при постоянной температуре.
Рассмотрим двухкомпонентные системы, когда на кривой охлаждения имеется одна горизонтальная остановка. Из правила фаз следует, что если при постоянном давлении в системе из двух компонентов в равновесии находятся три фазы, то система не имеет ни одной степени свободы. Таким образом, горизонтальный участок на кривой охлаждения двухкомпонентной системы указывает на то, что при температурной остановке в равновесии находятся три фазы (две твердые и одна жидкая). Если кристаллизующая твердая фаза (твердый раствор, чистый компонент или определенное соединение) отличается по составу от существующей в ней жидкости, то при охлаждении жидкой фазы от начальной температуры в точке α до темературы в начале кристаллизации в точке b (кривая 3) кривая охлаждения плавно идет вниз. В момент появления твердой фазы, вследствие выделения теплоты кристаллизации, скорость охлаждения уменьшается. Поэтому на кривой охлаждения в точке b появляется излом, отвечающий температуре начала кристаллизации. При этом число степеней свободы уменьшается на единицу, система из дивариантной становится моновариантной. Если на протяжении всего процесса кристаллизации в равновесии с жидкой фазой находится только одна твердая фаза, то затвердевание заканчивается при температуре в точке с. Наблюдаемый при этой температуре второй излом на кривой охлаждения отвечает полному исчезновению жидкой фазы и, следовательно, приобретению одной степени свободы, система из моновариантной становится дивариантной. Однако, если в конце кристаллизации появляется еще одна твердая фаза, кроме той которая выделилась первично, то система теряет еще одну степень свободы и затвердевание заканчивается инвариантным равновесием, которому отвечает горизонтальный участок се (кривая 4). По окончании затвердевания система, состоящая из двух твердых фаз, имеет одну степень свободы, охлаждение ее идет по плавной кривой и заканчивается при температуре d.
Система, отдавая теплоту окружающей среде, проходит ряд последовательных состояний равновесия и ее температура во всех точках одинакова. Однако на практике эти условия никогда не могут быть полностью соблюдены и экспериментально получаемые кривые охлаждения всегда в той или иной мере отклоняются от идеального хода. Одной из наиболее частых причин таких отклонений является переохлаждение. При переохлаждении температура в точке α плавно падает ниже точки равновесной кристаллизации b. В точке b наблюдается неустойчивое переохлаждение системы и по этому вследствие самопроизвольного возникновения центра кристаллизации начинается выпадение твердой фазы. Выделяющаяся теплота быстро повышает температуру, которая при благоприятных условиях (больших теплоте кристаллизации и скорости роста кристаллов) поднимается до температуры равновесной кристаллизации отвечающей остановке bc на кривой 5. При малой скорости кристаллизации температура может и не достигнуть уровня горизонтального участка bc (кривая 5).
Рассмотрим диаграмму плавкости двух неизоморфно кристаллизующихся веществ с простой эвтектикой и проследим за изменениями, происходящими с жидкостями различного состава при охлаждении (Рис.2). Вещества А и В неограничено растворимы в жидком состоянии, не образуют химических соединений, не претерпевают полиморфных превращений и кристаллизуются из жидкости в виде чистых компонентов.
Системы, лежащие выше линий АЕ и ВЕ, дивариантны, так как здесь два компонента и одна жидкая фаза (L). Кривые АЕ и ВЕ называются
t0C
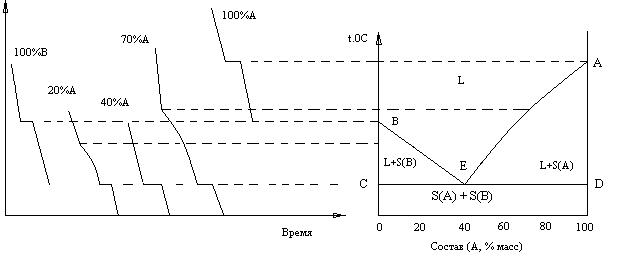
Рис.2. Диаграмма плавкости неизоморфной бинарной системы
кривыми ликвидуса. На этих кривых системы моновариантны. Прямая СD называется линией солидуса. В точке пересечения кривых ликвидуса Е оба твердых компонента находятся в равновесии с жидким расплавом состава, отвечающего точке Е. Ниже температуры точки Е (ниже линии CD) могут существовать только смеси компонентов (SA + SB). Среди всех сочетаний компонентов А и В расплав состава, отвечающего точке Е, имеет более низкую температуру кристаллизации. Точка Е называется эвтектической, а отвечающая ей смесь кристаллов А и В – эвтектической смесью, или эвтектикой. Эвтектика – состав из двух (или нескольких) компонентов, имеющий определенную характерную структуру, образующий при плавлении расплав, насыщенный относительно всех входящих в него компонентов.Составные части эвтектики хорошо видны под микроскопом и могут быть отделены от друг друга механическим путем или с помощью растворителей.
В эвтектической точке Е и по все линии СD (кроме крайних точек) система инвариантна, здесь три фазы: две твердые (SA + SB) и одна жидкая (L) (эвтектического состава). Если раствор идеален, то граничные кривые ликвидуса будут подчиняться уравнению Шредера:
ln Ni = 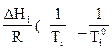 ),
),
где Ni – молярное содержание i-того компонента, доля;  - теплота плавления i-того компонента; Т
- теплота плавления i-того компонента; Т - температура плавления i-того компонента.
- температура плавления i-того компонента.
Кривые ликвидуса можно рассматривать как кривые зависимости каждого чистого компонента в растворе от температуры. Для идеальных растворов по таким кривым можно вычислить теплоту плавления  каждого компонента. И, наоборот, если значения теплоты плавления компонентов известны, можно рассчитать температуру кристаллизации эвтектики и ее состав. Для реальных растворов уравнение Шредера примет вид:
каждого компонента. И, наоборот, если значения теплоты плавления компонентов известны, можно рассчитать температуру кристаллизации эвтектики и ее состав. Для реальных растворов уравнение Шредера примет вид:
ln γiNi = -  ,
,
Экспериментальная часть
Приборы и реактивы: пробирки с термометрами со шкалой 0-1000С и мешалками (6 шт.); химические стаканы на 1 дм3 для водяной бани и воздушной рубашки (2 шт.); электроплитка; системы из органических веществ А-В составов: 100% А, 80%А; 60%А; 40%А; 20%А, 100%В массой по 5 г (А – нафталин; В – фенол).