рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Тепловой баланс конверсии природного газа 1 ступени
Реферат Курсовая Конспект
Тепловой баланс конверсии природного газа 1 ступени
Тепловой баланс конверсии природного газа 1 ступени - раздел Химия, Материальный баланс конверсии природного газа 1 ступени Цель Расчета Теплового Баланса Конверсии Природного Газа 1 Ст...
Цель расчета теплового баланса конверсии природного газа 1 ступени:
– определение прихода тепла в радиантную зону трубчатой печи со всеми потоками
– определение расхода тепла на выходе из трубчатой печи со всеми потоками
- определение объема природного газа.
Уравнение теплового баланса радиантной зоны:
Q1 + Q2 + Q3 + Q4 = Q5 + Q6 + Q7 + Q8 , (10)
где Q1 – физическое тепло паро-газовой смеси (технологический ПГ + АВС); Q2 – физическое тепло топливного ПГ; Q3 – физическое тепло воздуха, подаваемого в горелки; Q4 – теплота сгорания топлива; Q5 – расход тепла на эндотермические реакции (1) и (4); Q6 – физическое тепло конвертированного газа; Q7 – физическое тепло дымовых газов; Q8 – потери тепла в окружающую среду.
Обозначим :
х – объем топливного ПГ (м3), сжигаемого в печи на 100 м3 технологического ПГ для получения горячих дымовых газов.
Расчет прихода тепла.
Физическое тепло газовой смеси можно рассчитать по формуле:
Q = V×с×t, кДж (11)
где V – объем смеси, м3; с – средняя теплоемкость смеси, кДж/(м3×град); t – температура смеси, 0С.
Средняя теплоемкость смеси определяется по правилу аддитивности:
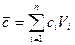 , кДж/(м3×град), (12)
, кДж/(м3×град), (12)
где сi – теплоемкость i-го компонента, кДж/(м3×град); Vi – содержание компонента в смеси, доли единицы; n – число компонентов.
Расчет Q1 - физического тепла парогазовой смеси (технологический ПГ + АВС)
Объем смеси V = 230 + 110 = 340 м3
Температура смеси t = 390 0С
1) Рассчитаем ссг – среднюю изобарную теплоемкость сухого газа, кДж/(м3×град)
Теплоемкости компонентов паро-газовой смеси (ПГС) при 3900 С (т.е. при 663 К) находим по [5, стр. 56] и приводим в таблице 6.
Таблица 6 - Теплоемкости компонентов ПГС.
| Компонент | Теплоемкость с, кДж/(кмоль×К) | Теплоемкость с, кДж/(м3×К) |
| СН4 | 45,854 | 2,047 |
| С2Н6 | 75,345 | 3,364 |
| С3Н8 | 108,251 | 4,833 |
| С4Н10 | 141,68 | 6,325 |
| N2 | 29,922 | 1,336 |
| Н2 | 29,102 | 1,299 |
| Ar | 20,78 | 0,928 |
По формуле (12) рассчитаем среднюю теплоемкость ПГС используя таблицы 6 и 3:
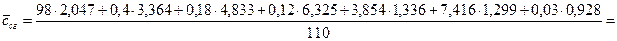 = 1,985 кДж/(м3×К)
= 1,985 кДж/(м3×К)
2) теплоемкость пара при 663 К [5]:
сН2О = 35,323 кДж/(кмоль×К)
сН2О = 35,323/22,4 = 1,577 кДж/(м3×К)
3) Рассчитаем Q1 по формуле (11):
Q1 = (110×1,985 + 230×1,577)390 = 226613,4 кДж
Расчет Q2 - физическое тепло топливного ПГ
Обозначим объем топливного природного газа V = х м3
Примем температуру топливного природного газа равной t = 85 0С.
1) Рассчитаем спг – среднюю изобарную теплоемкость природного газа при температуре 358 К.
Теплоемкости компонентов природного газа при 358 К вычисляем интерполяцией по данным [5, стр. 56] и приводим в таблице 7.
Таблица 7 - Теплоемкости компонентов топливного ПГ.
| Компонент | Теплоемкость с298, кДж/(кмоль×К) | Теплоемкость с500, кДж/(кмоль×К) | Теплоемкость с358 | |
| кДж/(кмоль×К) | кДж/(м3×К) | |||
| СН4 | 35,71 | 41,16 | 37,33 | 1,667 |
| С2Н6 | 52,64 | 66,21 | 56,67 | 2,530 |
| С3Н8 | 73,51 | 94,39 | 79,71 | 3,558 |
| С4Н10 | 97,585 | 124,29 | 105,517 | 4,711 |
| N2 | 29,12 | 29,58 | 29,26 | 1,306 |
Теплоемкость топливного ПГ находим по формуле (12) используя таблицу 7 и 3:
 1,672 кДж/(м3×К)
1,672 кДж/(м3×К)
По формуле (11) выразим Q2 на х м3 топливного ПГ:
Q2 = х×1,672×85 = 142,12∙х кДж (13)
Расчет Q3 - физическое тепло воздуха, подаваемого в горелки
Выразим физическое тепло влажного воздуха, поступающего в горелки.
Физическое тепло влажного воздуха определяем по формуле:
Q3 = m×НВЛ , кДж (14)
где m – масса сухого воздуха, кг; НВЛ – энтальпия влажного воздуха, кДж/кг сухого воздуха.
Рассчитаем объем и массу сухого воздуха, идущего на сжигание 1 м3 природного газа, затем определим физическое тепло влажного воздуха.
1) Рассчитаем теоретический объем О2 , необходимый для сжигания 1 м3 топливного ПГ:
СН4 + 2О2 = СО2 + 2Н2О (15)
С2Н6 + 3,5О2 = 2СО2 + 3Н2О (16)
С3Н8 + 5О2 = 3СО2 + 4Н2О (17)
С4Н10 + 6,5О2 = 4СО2 + 5Н2О (18)
на 0,979 м3 СН4 требуется 2×0,979 = 1,958 м3 О2
на 0,004 м3 С2Н6 требуется 3,5×0,004 = 0,014 м3 О2
на 0,0018 м3 С2Н6 требуется 5×0,0018 = 0,009 м3 О2
на 0,0012 м3 С2Н6 требуется 6,5×0,0012 = 0,0078 м3 О2
всего 1,9888 м3 О2
Примем коэффициент избытка воздуха: 1,15.
С учетом избытка воздуха:
1,9888×1,15 = 2,287 м3 О2
Примем состав воздуха, % об.: О2 – 21; N2 – 78; Ar – 1.
Расход сухого воздуха на 1 м3 топливного ПГ составит:
2,287×100/21 = 10,891 м3
Масса сухого воздуха (молярная масса воздуха равна 28,96 кг/кмоль):
m = 10,891×28,96/22,4 = 14,081 кг
Примем относительную влажность воздуха равной 80%, а температуру воздуха, подаваемого в горелки 250С.
При заданных относительной влажности (80 %) и температуре (250 С) воздуха по диаграмме Рамзина [6, стр. 16] определяем энтальпию и влагосодержание (d) воздуха:
НВЛ = 66,53 кДж/кг сухого воздуха
d = 0,01629 кг/кг сухого воздуха
Выражаем Q3 на х м3 топливного ПГ:
Q3 = 14,081∙66,53∙х = 936,809∙х кДж
Рассчитаем массу и объем влаги, внесенной с воздухом на 1 м3 топливного ПГ:
mВЛ = 0,01629×14,081 = 0,229 кг
Что в пересчете на объем составляет:
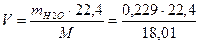 =0,285 м3
=0,285 м3
Этот объем водяных паров будет учтен в расчете состава дымовых газов.
Расчет Q4 - теплоты сгорания топлива
Теплоту, выделяющуюся при сгорании топлива, определяем по формуле:
Q = V×QСГ, кДж, (19)
где V – объем топлива, м3; QСГ – теплота сгорания, кДж/м3.
Теплота сгорания смеси углеводородов (топливный ПГ) рассчитаем по реакциям (15)-(18). Рассчитаем энтальпию реакций по справочным данным.
Изменение стандартной энтальпии в химической реакции определяется по следствию из закона Гесса:
∆Н298= Σ Н0298прод - Σ Н0298реагентов (20)
Воспользуемся справочными данными [5, стр. 45] и определим энтальпии веществ (таблица 8).
Таблица 8 – Энтальпии образования веществ.
| Компонент | ΔН0298, кДж/моль |
| СН4 | -74,85 |
| С2Н6 | -84,67 |
| С3Н8 | -103,85 |
| С4Н10 | -126,329 |
| О2 | |
| СО2 | - 393,51 |
| Н2О | -241,81 |
По формуле (20) для реакции (15):
∆Н298= (2∙(-241,81)+1∙(-393,51)) – (1∙(-74,85) + 2∙0) = -802,28 кДж
Тепловой эффект равен 802,28 кДж.
Аналогично рассчитаем тепловой эффект реакций:
Для (16) тепловой эффект равен 1427,78 кДж.
Для (17) тепловой эффект равен 2043,92 кДж.
Для (18) тепловой эффект равен 2656,76 кДж.
Рассчитаем тепло, выделившееся при сгорании 1м3 природного газа. Вычисленные энтальпии реакций соответствуют 1 моль СН4, 1 моль С2Н6 , 1 моль С3Н8 , 1 моль С4Н10. С учетом мольного объема (0,0224 м3моль) вычислим тепло, выделяющееся при сгорании каждого компонента 1 м3 природного газа.
При сгорании СН4 выделяется:
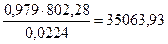 кДж
кДж
При сгорании С2Н6 выделяется:
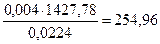 кДж
кДж
При сгорании С3Н8 выделяется:
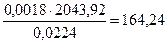 кДж
кДж
При сгорании С4Н10 выделяется:
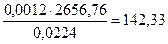 кДж
кДж
Определяем теплоту сгорания смеси:
QСГ = 35063,93 + 254,96 + 164,24 + 142,33 = 35625,46 кДж/м3
По формуле (19) выразим (пренебрегая содержанием N2 в топливном ПГ):
Q4 = 35625,46 ∙х, кДж
Приход тепла
Приход тепла составляет:
QПРИХ = 226613,4 + 142,12∙х + 936,809∙х + 35625,46 ∙х =
= 226613,4 + 36704,389∙х кДж
Расчет расхода тепла.
Расчет Q5 - расход тепла на эндотермические реакции (1) и (4)
При расчете материального баланса учли, что часть СО, получающаяся в каталитических трубах по сильно эндотермическим реакциям (1), (5) – (7), превращается там же в СО2 по слабо экзотермической реакции (4), поэтому часть тепла реакций (1), (5) – (7) компенсируется теплом реакции (4).
Однако большую часть тепла, необходимую для протекания эндотермических реакций, все же необходимо подвести из вне, т.е. сжиганием природного газа в межтрубном пространстве печи.
По результатам расчета материального баланса известен состав технологического газа на входе в зону катализа (Таблица 3) и на выходе из нее (Таблица 4). Тогда для расчета потребности в тепле для эндотермических реакций воспользуемся законом Гесса:
DН0298 = S DН0298,i×Vi - S DН0298,j×Vj , кДж (21)
где DН0298,i,Vi– теплота образования, объем конечных веществ; DН0298,j,Vj – теплота образования, объем исходных веществ.
Объемные энтальпии образования рассчитываются исходя из мольных энтальпий образования веществ.
Таблица 9 – Энтальпии образования веществ.
| Компонент | ΔН0298, кДж/моль | ΔН0298, кДж/м3 |
| СН4 | -74,85 | -3341,5 |
| С2Н6 | -84,67 | -3779,9 |
| С3Н8 | -103,85 | -4636,2 |
| С4Н10 | -126,329 | -5639,7 |
| N2 | ||
| Н2 | ||
| Аr | ||
| СО | - 110,53 | -4934,4 |
| СО2 | - 393,51 | -17567,4 |
| Н2О | -241,81 | -10795,1 |
По формуле (21):
DН0298 = (-3341,5×30,7511 - 4934,4×37,1959 - 17567,4×31,873 - 10795,1×129,0581) – (-3341,5×98 – 3779,8×0,4 – 4636,2×0,18 – 5639,7∙0,12 – 10795,1×230) = 573948,1 кДж
Положение энтальпии процесса свидетельствует о том, что процесс эндотермический и необходим подвод тепла.
Расчет Q6 - физическое тепло конвертированного газа
Объем газа V = 470,7218 м3 (Таблица 4)
Температура газа t = 700 0С
1) Рассчитаем сг – среднюю изобарную теплоемкость конвертированного газа при температуре 973 К.
Теплоемкости компонентов конвертированного газа при 973 К вычисляем интерполяцией по данным [5, стр. 56] и приводим в таблице 10.
Таблица 10 - Теплоемкости компонентов конвертированного газа.
| Компонент | Теплоемкость с900, кДж/(кмоль×К) | Теплоемкость с1000, кДж/(кмоль×К) | Теплоемкость с973 | |
| кДж/(кмоль×К) | кДж/(м3×К) | |||
| СН4 | 52,16 | 54,66 | 53,995 | 2,410 |
| СО | 30,69 | 30,92 | 30,858 | 1,378 |
| СО2 | 46,44 | 47,15 | 46,967 | 2,097 |
| Н2 | 29,42 | 29,56 | 29,522 | 1,318 |
| N2 | 30,42 | 30,63 | 30,573 | 1,365 |
| Ar | 20,78 | 20,78 | 20,78 | 0,928 |
| Н2О | 36,57 | 37,07 | 36,937 | 1,649 |
Теплоемкость конвертированного газа находим по формуле (12) используя таблицу 10 и 4:
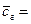 0,06533∙ 2,410 + 0,07902∙1,378 + 0,06771∙2,097 + 0,00819∙1,365 + 0,50552∙1,318 + 0,00006∙0,928 + 0,27417∙1,649 = 1,538 кДж/(м3×К)
0,06533∙ 2,410 + 0,07902∙1,378 + 0,06771∙2,097 + 0,00819∙1,365 + 0,50552∙1,318 + 0,00006∙0,928 + 0,27417∙1,649 = 1,538 кДж/(м3×К)
По формуле (11) рассчитаем Q6 :
Q6 = 470,7218 ∙700∙1,538 = 506779,1 кДж
Расчет Q7 - физическое тепло дымовых газов
1) Рассчитаем объем дымовых газов.
Дымовые газы образуются в межтрубном пространстве печи при сгорании природного газа в токе воздуха и состоят из негорючих компонентов исходных веществ, избыточного кислорода, а так же продуктов сгорания.
Рассчитаем объем дымовых газов, образующихся при сжигании 1 м3 природного газа. Воспользуемся данными расчета объема воздуха.
Объем азота складывается из объема азота воздуха и примеси азота в природном газе:
VN2 = 0,78∙10,891+0,014 = 8,50898 м3
Объем кислорода:
VО2 = 2,287 - 1,9888 = 0,2982 м3
Объем аргона:
VAr = 10,891∙0,01 = 0,10891 м3
Рассчитаем объем продуктов сгорания:
VСО2 = 0,979 + 2∙0,004 + 3∙0,0018 + 4∙0,0012 = 0,9972 м3
VН2О = 2∙0,979 + 3∙0,004 + 4∙0,0018 + 5∙0,0012 = 1,9832 м3
К реакционному водяному пару нужно добавить пары воды, поступающие с влажным воздухом. Общий объем водяного пара:
VН2О = 1,9832 + 0,285 = 2,2682 м3
Заполним таблицу для объема и состава дымовых газов в расчете на 1 м3 топлива.
Таблица 11 – Состав дымовых газов
| Компонент | Объем, м3 | Состав, % об. |
| СО2 | 0,9972 | 8,19 |
| N2 | 8,50898 | 69,85 |
| О2 | 0,2982 | 2,45 |
| Ar | 0,10891 | 0,89 |
| Н2О | 2,2682 | 18,62 |
| Всего | 12,182 | 100,0 |
Таким образом, при сгорании 1 м3 природного газа образуется 12,182 м3 газов. Тогда при сгорании х м3 природного газа образуется объем дымовых газов, равный 12,182∙х м3.
2) Рассчитаем среднюю теплоемкость дымовых газов при температуре 8500С.
Таблица 12 - Теплоемкости компонентов дымовых газов.
| Компонент | Теплоемкость с1000, кДж/(кмоль×К) | Теплоемкость с1200, кДж/(кмоль×К) | Теплоемкость с1123 | |
| кДж/(кмоль×К) | кДж/(м3×К) | |||
| СО2 | 47,15 | 48,53 | 48,003 | 2,143 |
| N2 | 30,63 | 31,05 | 30,887 | 1,379 |
| О2 | 32,43 | 32,97 | 32,781 | 1,463 |
| Ar | 20,78 | 20,78 | 20,78 | 0,928 |
| Н2О | 37,07 | 38,12 | 37,709 | 1,683 |
Теплоемкость дымовых газов находим по формуле (12) используя таблицу 11 и 12:
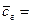 0,0819∙2,143 + 0,6985∙1,379 + 0,0245∙1,463 + 0,0089∙0,928 +
0,0819∙2,143 + 0,6985∙1,379 + 0,0245∙1,463 + 0,0089∙0,928 +
+ 0,1862∙1,683 = 1,496 кДж/(м3×К)
По формуле (11) выразим Q7 :
Q7 = 12,182∙х ∙850∙1,496 = 15490,63 ∙ х кДж
Расчет Q8 - потери тепла в окружающую среду
Выразим Q8 = 0,03∙ QПРИХ = 0,03∙(226613,4 + 36704,389∙х) =
= 6798,402+1101,1317∙х
Расход тепла
Расход тепла составляет:
QРАСХ = 573948,1 + 506779,1 + 15490,63 ∙ х + 6798,402+1101,1317∙х =
= 1087525,602 + 16591,7617∙х кДж
Согласно условию теплового баланса приход тепла равен его расходу:
QПРИХ = QРАСХ
226613,4 + 36704,389∙х = 1087525,602 + 16591,7617∙х
х = 42,805 м3
Таким образом, объем топливного природного газа составил 42,805 м3, который соответствует 100 м3 технологического природного газа.
Рассчитаем выраженные тепловые потоки и составим таблицу теплового баланса:
Q2 = 142,12∙42,805 = 6083,4466 кДж
Q3 = 936,809∙42,805 = 40100,109 кДж
Q4 = 35625,46 ∙42,805 = 1524947,815 кДж
Q7 = 15490,63 ∙ 42,805 = 663076,417 кДж
Q8 = 6798,402+1101,1317∙42,805 = 53932,344 кДж
Таблица 13 - Тепловой баланс процесса конверсии природного газа в трубчатой печи
| Приход | Расход | ||||
| Поток | кДж | % | Поток | кДж | % |
| Q1 – физическое тепло паро-газовой смеси | 226613,4 | 12,605 | Q5 – расход тепла на эндотермические реакции | 573948,1 | 31,926 |
| Q2 – физическое тепло топливного ПГ | 6083,4466 | 0,338 | Q6 – физическое тепло конвертированного газа | 506779,1 | 28,190 |
| Q3 – физическое тепло воздуха, подаваемого в горелки | 40100,109 | 2,231 | Q7 – физическое тепло дымовых газов | 663076,417 | 36,884 |
| Q4 – теплота сгорания топлива | 1 524 947,815 | 84,826 | Q8 – потери тепла в окружающую среду | 53932,344 | 3,000 |
| Итого | 1797744,771 | 100,000 | Итого | 1797735,961 | 100,000 |
Невязка:
Δ = 0,0005%
Тепло, передаваемое дымовыми газами через стенки трубок, составляет:
QР = (6083,4466 + 40100,109 + 1524947,815) – 663076,417 = 908054,954 кДж
Пересчитаем это количество теплоты в Вт:
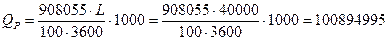 Вт,
Вт,
Скорость превращения парогазовой смеси в конечные продукты зависит от распределения температурных полей, скорости передачи тепла и гидродинамического сопротивления в слое катализатора и, главным образом, от скоростей химических реакций на поверхности катализатора.
Исследования В. И. Атрощенко, Г.Л. Звягинцева и других показали, что паровая каталитическая конверсия природного газа под давлением до 4,01 МПа описывается уравнением:
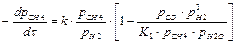 , (22)
, (22)
где рi – парциальное давление соответствующего компонента конвертированного газа, Па; t - время контакта, с; К1 – константа равновесия реакции (1), Па2; к – константа скорости реакции, Па×с-1.
Математическая модель суммарного процесса включает в себя соответствующие математические описания указанных элементарных процессов. Следует учитывать невозможность стационарности работы катализатора в промышленных условиях. Обычно при расчетах объема катализатора это обстоятельство учитывают с помощью коэффициента запаса.
Внутренний диаметр реакционных труб (dВ, м) и число труб (n) определяют по формулам:
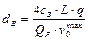 , (23)
, (23)
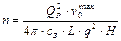 , (24)
, (24)
где q – теплонапряжение поверхности труб, Вт/м2; L – количество природного газа, подаваемого в реакционные трубы, м3/с; сЗ – коэффициент запаса; QР – количество тепла, передаваемое через стенки реакционных труб (определяется на основании теплового баланса трубчатой печи), Вт.
Объемную скорость конвертируемого природного газа (v0, с-1) определяют по формуле:
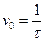 (25)
(25)
Если тепловые, гидродинамические и прочностные условия не лимитируют скорость суммарного процесса, максимально возможную скорость процесса 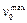 рассчитывают по уравнению (25), а объем загруженного в трубы катализатора по формуле:
рассчитывают по уравнению (25), а объем загруженного в трубы катализатора по формуле:
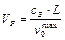 , (26)
, (26)
По опытным данным известно, что время контакта составляет 0,896 с [3, стр. 36]. Тогда объемная скорость конвертируемого природного газа равна
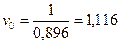 с-1
с-1
Коэффициент запаса на объем катализатора примем равным 2, количество природного газа, подаваемое в реакционные трубы - 40 000 м3/ч.
По формуле (26) определяем объем загруженного в трубы катализатора:
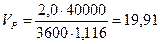 м3
м3
Теплонапряжение поверхности труб по [1, стр.64] принимаем равным:
q = 8,723×104 Вт/м2
По формулам (22) – (23) определяем внутренний диаметр реакционных труб и число труб:
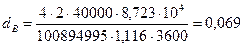
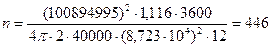
На практике n = 502 [4, стр.72]. Уменьшение внутреннего диаметра и увеличение числа реакционных трубок интенсифицируют теплообмен в трубчатой печи, который является лимитирующей стадией конверсии. Однако при этом возрастают затраты металла и удорожается установка.
Оптимальное сочетание перечисленных факторов может быть определено только на основании технико-экономического расчета.
– Конец работы –
Эта тема принадлежит разделу:
Материальный баланс конверсии природного газа 1 ступени
На сайте allrefs.net читайте: 5.2 Материальный баланс конверсии природного газа 1 ступени……33...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Тепловой баланс конверсии природного газа 1 ступени
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов