Катализ
Вещества, ускоряющие химическую реакцию – катализаторы.
Катализ – изменение скорости реакции под действием катализатора.
Ингибиторы – уменьшают скорость.
Катализатор вступает во взаимодействие с реагирующими веществами с образованием промежуточных продуктов и направляет процесс по новому реакционному пути. Механизм действия катализатора заключается в изменении пути процесса превращения. Новый путь характеризуется меньшей энергией активации.
1) Без кат:
А +В → А…В → АВ
2) С кат:
А + К « АК
АК + В → В…АК
В…АК → АВ + К
(Рис. презентация МГУ, с 39)
Поскольку, согласно уравнению Аррениуса, константа скорости химической реакции находится в экспоненциальной зависимости от величины энергии активации, уменьшение последней вызывает значительное увеличение константы скорости. Действительно, если предположить, что предэкспоненциальные множители в уравнении Аррениуса (II.32) для каталитической и некаталитической реакций близки, то для отношения констант скорости можно записать:
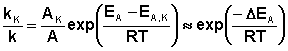 (II.44)
(II.44)
Катализатор не влияет на термодинамику, не изменяют энтальпию и энергию Гиббса, не влияет на константу равновесия.
Гомогенные каталитические реакции: все реагенты и катализатор в одной фазе.
Примеры:
СО +О2 → СО2 (кат – Н2О г)
СН3СНО → СН4 + СО (кат – I2 г)
Н2О2 → Н2О + О2 (тяжелые металлы, Fe2+, кровь, I-)
Гетерогенный катализ – реагирующая система и катализатор находятся в разных фазах.
Несколько стадий процесса
1) диффузия частиц к катализатору
2) адсорбция на поверхности катализатора
3) хим. реакция
4) десорбция
5) диффузия продуктов от поверхности
Н2 +О2 → Н2О (губчатая платина)
N2 +H2 → NH3 (Fe3O4, Cr2O3)
Специфической особенностью гетерокаталитических процессов является способность катализатора к промотированию и отравлению.
Промотирование – увеличение активности катализатора в присутствии веществ, которые сами не являются катализаторами данного процесса (промоторов). Например, для катализируемой металлическим никелем реакции
СО + Н2 ––> СН4 + Н2О
введение в никелевый катализатор небольшой примеси церия приводит к резкому возрастанию активности катализатора.
Отравление – резкое снижение активности катализатора в присутствии некоторых веществ (т. н. каталитических ядов). Например, для реакции синтеза аммиака (катализатор – губчатое железо), присутствие в реакционной смеси соединений кислорода или серы вызывает резкое снижение активности железного катализатора; в то же время способность катализатора адсорбировать исходные вещества снижается очень незначительно.