Необратимые реакции
Реакции нулевого порядка.
0-порядок по веществу встречается в гетерогенных реакциях. Для реакций нулевого порядка кинетическое уравнение имеет следующий вид:
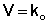 (II.5)
(II.5)
Скорость реакции нулевого порядка постоянна во времени и не зависит от концентраций реагирующих веществ; это характерно для многих гетерогенных (идущих на поверхности раздела фаз) реакций в том случае, когда скорость диффузии реагентов к поверхности меньше скорости их химического превращения. [k]=моль/л с.
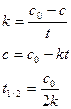
Реакции первого порядка.
А→В + С
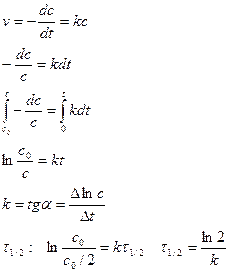
(Рис. 2.6 Семиохин, с.23)
[k]=1/c
В качестве критерия скорости используют время полураспада – время, за которое концентрация реагента уменьшается в два раза. Для реакций первого порядка период полупревращения не зависит от концентрации исходного вещества.
Примеры необратимых реакций первого порядка.
2N2O5=4NO2 +O2
Это бимолекулярная реакция первого порядка( Карапетьянц, с. 233)
СH3OCH3 = CH4 + H2 + CO
Все реакции радиоактивного распада, гидролиз сложных эфиров в присутствии сильных кислот как катализаторов (это псевдопервый порядок за счет большого избытка воды)
Реакции второго порядка.
А + В → C + D

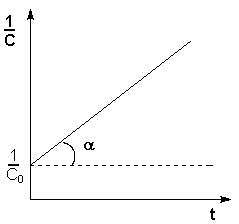
[k]=л/моль с