Уравнение Аррениуса
Очевидно, что взаимодействие частиц осуществляется при их столкновениях; однако число столкновений молекул очень велико и, если бы каждое столкновение приводило к химическому взаимодействию частиц, все реакции протекали бы практически мгновенно. Аррениус постулировал, что столкновения молекул будут эффективны (т.е. будут приводить к реакции) только в том случае, если сталкивающиеся молекулы обладают некоторым запасом энергии – энергией активации.
Энергия активации есть минимальная энергия, которой должны обладать молекулы, чтобы их столкновение могло привести к химическому взаимодействию.
Уравнение Аррениуса описывает зависимость константы скорости реакции от температуры и величины энергии активации
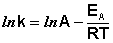 (II.36)
(II.36)
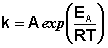 (II.37)
(II.37)
Энергия активации рассчитывается из экспериментальных данных двумя способами: графическим и аналитическим. Надо построить график зависимости lnk от1/T. Тогда на оси абсцисс отсекается отрезок lnk0, а tg a=-Ea/R.
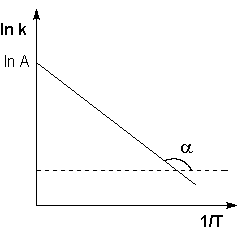
Рис. 2.7 Зависимость логарифма константы скорости химической
реакции от обратной температуры.
Аналитический способ предполагает сравнение скоростей при двух температурах:
lnk1=lnk0-Ea/RT1
lnk2=lnk0-Ea/RT2
lnk2/k1=Ea(T2-T1)/RT1T2
Механизмы реакций.
Последовательность отдельных стадий – механизм реакции.
О механизме реакции судят по экспериментальным данным, описывающим скорости протекания, а также по обнаружению промежуточных продуктов реакции.