рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- Температура замерзания раствора.
Реферат Курсовая Конспект
Температура замерзания раствора.
Температура замерзания раствора. - раздел Химия, Лекция № 5. Фазовые равновесия. Растворы неэлектролитов Кристаллы Растворителя Будут Находиться В Равновесии С Раствором Только Тогда...
Кристаллы растворителя будут находиться в равновесии с раствором только тогда, когда давление насыщенного пара над кристаллами и над раствором одинаково. Поскольку давление пара растворителя над раствором всегда ниже, чем над чистым растворителем, температура, отвечающая этому условию, всегда будет более низкой, чем температура замерзания чистого растворителя. При этом понижение температуры замерзания раствора ΔTзам не зависит от природы растворенного вещества и определяется лишь соотношением числа частиц растворителя и растворенного вещества.
Можно показать, что понижение температуры замерзания раствора ΔTзам прямо пропорционально моляльной концентрации раствора:
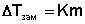
Второй закон Рауля: Повышение Ткип и понижение Тзам р-ра пропорциональны числу частиц растворенного вещества и не зависят от его природы.
– Конец работы –
Эта тема принадлежит разделу:
Лекция № 5. Фазовые равновесия. Растворы неэлектролитов
Газообразное состояние вещества характеризуется слабым взаимодействием между частицами и большими расстояниями между ними Поэтому газы смешиваются... Общее давление газовой смеси равно сумме парциальных давлений всех входящих в...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: Температура замерзания раствора.
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов