Ковалентная связь
Химическая связь, осуществляемая за счет перекрывания электронных облаков взаимодействующих атомов, называется ковалентной связью.
4.3.1. Неполярная ковалентная связь. Механизм возникновения ковалентной связи рассмотрим на примере образования молекулы водорода.
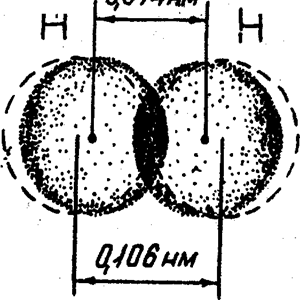
- Образование молекулы Н2. Ядро свободного атома водорода окружено сферически симметричным электронным облаком. При сближении атомов до определенного расстояния происходит перекрывание их электронных облаков с образованием молекулярного облака, обладающего максимальной электронной плотностью в пространстве между ядрами. Если у сблизившихся до касания атомов водорода расстояние между ядрами составляет 0,106 нм, то после перекрывания (образования молекулы Н2) это расстояние сокращается до 0,074 нм (рис. 7). Увеличение плотности отрицательно заряженного электронного облака между положительно заряженными ядрами приводит к тому, что ядра как бы стягиваются этим облаком и возникает химическая связь.
Таким образом, ковалентная связь обеспечивается силами электростатического притяжения между сосредоточенной электронной плотностью в межъядерном пространстве, возникшей в результате перекрывания электронных облаков, и положительными зарядами ядер. Ковалентная связь тем прочнее, чем вше степень перекрывания электронных облаков. В результате возникновения связи между атомами водорода каждый атом достигает электронной
конфигурации инертного элемента гелия:
 < Н ∙ + ∙ Н → Н :Н или Н2
< Н ∙ + ∙ Н → Н :Н или Н2
|
каждого атома. В результате
образуется общая электронная
пара, которая в равной мере принадлежит обоим атомам и, благодаря чему, каждый атом хлора завершает свой энергетический уровень, достигая конфигурации инертного элемента аргона:
∙ ∙ ∙ ∙ ∙ ∙ ∙ ∙
: С1 ∙ + ∙ С1 → : С1 :С1 :или С12
∙ ∙ ∙ ∙ ∙ ∙ ∙ ∙
Или, с точки зрения строения атома, это можно представить так:
электронная формула атома хлора Is22s22p63s23Sp5




↑↓ ↑↓ ↑↓ ↑
 3s 3р
3s 3р
При образовании молекулы происходит перекрывание р-орбиталей (рис. 8).
P P P - P
 | |||||||
 |  | ||||||
 | |||||||
+ -













Cl Cl Cl2
Рис. 8. Схема образования химической связи в молекуле хлора.
с точки зрения строения атома электронная формула атома азота выглядит так:



 ↑↓ ↑ ↑ ↑
↑↓ ↑ ↑ ↑
2s 2р
В молекуле азота связь осуществляется за счет перекрывания трех р-облаков, расположенных по оси х, у, z. Между атомами азота образуется одна сигма (σ) -связь и две пи – связи (π).
Связь, образованная при перекрывании электронных облаков вдоль линии, соединяющей центры взаимодействующих атомов, называется сигма (σ) - связью. Связь, образованная за счет перекрывания орбиталей по обе стороны от линии, соединяющей центры – атомов, называется пи – связью.
Наглядно это представлено на рисунке 9.
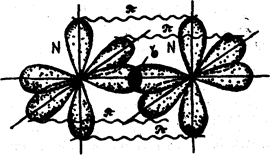
Рис. 9.Схема образования химической связи в молекуле азота.
Мы рассмотрели неполярную или гомеополярную ковалентную связь. При неполярной связи вероятность присутствия электронной плотности между ядрами одинакова. Центры тяжести положительных и отрицательных зарядов совпадают. Центром положительного заряда считают середину расстояния между ядрами. В молекулах простых газообразных веществ Н2, CI2, O2, N2 - в газообразной фазе наблюдается гомеополярная (неполярная) связь.
Вещества с неполярной ковалентной связью обладают низкими температурами кипения и плавления, в воде не диссоциируют, не проводят электрический ток.
4.3.2. Полярная ковалентная связь. Образование молекулы из атомов различных элементов происходит при помощи гетерополярной (полярной) ковалентной связи. Простейший случай гетерополярной связи — это образование молекулы хлорводорода. Образование молекулы НС1 можно представить схемой: