рефераты конспекты курсовые дипломные лекции шпоры
- Раздел Химия
- /
- ОСНОВЫ НЕОРГАНИЧЕСКОЙ ХИМИИ
Реферат Курсовая Конспект
ОСНОВЫ НЕОРГАНИЧЕСКОЙ ХИМИИ
ОСНОВЫ НЕОРГАНИЧЕСКОЙ ХИМИИ - раздел Химия, Таирова А.р. ...
Таирова А.Р.
ОСНОВЫ
НЕОРГАНИЧЕСКОЙ ХИМИИ
Учебное пособие
Троицк
Издательство УГАВМ
УДК 546 (075)
ББК 24.1
Т - 13
Рецензенты: Ким Д.Г., доктор химических наук, профессор, Челябинской государственный университет;
Жолнин А.В., доктор биологических наук, профессор Челябинская государственная медицинскаяакадемия;
Дерхо М.А., доктор биологических наук, доцент, Уральской государственной академии ветеринарной медицины.
Таирова А.Р.
Основы неорганической химии / Учебное пособие для студентов высших учебных заведений: Учебники и учебные пособия для высших сельскохозяйственных учебных заведений. - Троицк: Изд-во УГАВМ, 2006.- 184с.: ил.
В учебном пособии рассмотрены основные понятия и законы атомно-молекулярного учения, важнейшие классы и номенклатура неорганических веществ, вопросы строения атома, химической связи, энергетики химических процессов, химической кинетики, химического равновесия. Даны примеры и методические указания по решению задач.
ISBN 5–901987–61–6 © Таирова А.Р., 2006
© Изд-во УГАВМ, 2006
О Г Л А В Л Е Н И Е
Г л а в а 1. Атомно – молекулярное учение…………….……7
1.1.Основные законы и понятия химии………………………..7
1.2. Химическая символика……………………………………24
1.3. Классы неорганических веществ…………………………26
1.3.1. Оксиды……………………………………………….28
1.3.2. Кислоты……………………..………………………..31
1.3.3. Гидроксиды……………………………………………37
1.3.4. Соли ………………………….………………………..40
1.4. Номенклатура неорганических соединений (по правилам ИЮПАК)……………………………………………….……44
1.4.1. Названия для групп элементов….…………………..44
1.4.2. Систематические названия для соединений….……44
1.4.3. Названия для катионов и анионов………….………46
1.4.4. Номенклатура оснований и гидратов……..………..48
1.4.5. Номенклатура кислот………………………..………49
1.4.6. Номенклатура солей……………………….………..52
1.4.7. Комплексные соли. Номенклатура комплексных
соединений…………………………..….……………53
Г л а в а 2. Строение атома…………………..…………….…55
2.1. Первые модели атома…………………..………………....55
2.2. Атомные спектры………………………….…….………...56
2.3. Кванты и модель Бора……………………….………..…..57
2.4. Двойственная природа электрона…………..………….…58
2.5. Квантово – механическая модель атома….…………..….59
Г л а в а 3. Периодическая система Д.И. Менделеева…….70
3.1.Периодический закон и структура периодической системы Д.И. Менделеева….………………………………………..70
3.2. Периодическая система элементов Д.И. Менделеева
и электронная структура атомов…………………………..77
3.3. Периодические свойства элементов………………...……81
Г л а в а 4. Химическая связь и строение молекул……...90
4.1. Определение химической связи………………………….90
4.2. Ионная связь……………………………………………….91
4.3. Ковалентная связь…………………………………………94
4.3.1. Неполярная ковалентная связь…….……………….94
4.3.2. Полярная ковалентная связь…….………………….97
4.3.3. Свойства ковалентной связи……..…….………….100
4.4. Метод валентных связей (МВС, ВС)…..………….…….101
4.5. Метод молекулярных орбиталей (ММО, МО)…..……..107
4.5.1. Основные положения ММО, МО…………...…….110
4.5.2.Основные двухатомные гомонуклеарные молекулы
элементов 2-го периода……………………………114
4.5.3. Двухатомные гетеронуклеарные молекулы элементов 2-го периода……………..……………..120
4.6. Металлическая связь………………….…………………120
4.7. Водородная связь………………….……………………..123
4.8. Взаимодействия между молекулами……...…………....123
4.8.1. Вандерваальсовы силы…………………………….126
4.8.2. Донорно-акцепторное взаимодействие молекул. Комплексные соединения…………………………127
Г л а в а 5 . Энергетика химических процессов…….……127
5.1. Общие понятия…………………………….…………….128
5.2. Внутренняя энергия. Первый закон термодинамики…..129
5.3. Энтальпия системы. Тепловые эффекты химических
реакций……………..………………………….……….…130
5.4. Термохимические расчеты……………………………....134
5.5. Химическое сродство. Энтропия химических реакций.
Энергия Гиббса..................................................................136
5.6. Второй и третий законы термодинамики……..…...…...140
Г л а в а 6. Химическая кинетика и равновесие………...140
6.1. Понятие о скорости химических реакций………….…..142
6.2. Зависимость скорости реакции от концентрации
реагентов ……………… ………………………….…….144
6.3.Влияние температуры на скорость реакции……….……145
6.4. Энергия активации…………………………..……….…..148
6.5. Понятие о катализе и катализаторах…………..….…….151
6.6. Химическое равновесие. Принцип Ле Шателье………..157
Г л а в а 7. Растворы……………….………………..………158
7.1. Способы выражения концентрации растворов…...……160
7.2. Коллигативные свойства растворов………………...…..165
7.3. Растворы электролитов…………………………...……...165
7.3.1. Степень диссоциации электролитов…………...…...166
7.3.2. Слабые электролиты. Константа диссоциации..……169
7.3.3. Сильные электролиты………… ..………………......172
7.3.4. Ионное произведение воды. Водородный
показатель………………….……..………………...176
7.4. Гидролиз солей……………………...……………………184
Г л а в а 8. Окислительно-восстановительные
Процессы………………………………………….184
8.1 Степень окисления элементов…….…………..…………184
8.2. Окислительно-восстановительные реакции…...……….190
8.3. Составление уравнений окислительно-
восстановительных реакций…………………..………..193
8.3.1.Метод электронного баланса…...……………….…194
8.3.2. Ионно-электронный метод…………….…………..196
Г л а в а 9. Комплексные соединения……...………………204
9.1. Определение комплексных соединений……..…………204
9.2. Комплексообразователи……………………...………….206
9.3.Лиганды…………………………………………..……….206
9.4. Номенклатура комплексных соединений……..………..208
9.5. Диссоциация комплексных соединений……...…...……209
9.6. Константы устойчивости комплексов…………….. ….211
9.7.Роль комплексных соединений………………….. …… ..214
9.8. Комплексонометрия. Жесткость воды…………...……..215
Используемая литература…………………………………….217
Глава 1. Атомно – молекулярное учение
Атом – система взаимодействующих элементарных частиц, состоящая из ядра и электронов. Тип атома определяется составом его ядра. Ядро состоит из протонов и нейтронов, вместе называемых нуклонами. Элемент – совокупность атомов с одинаковым зарядом ядра, т.е. числом протонов. Атом – наименьшая частица элемента, обладающая его химическими свойствами. Атомы элемента могут иметь различные числа нейтронов в составе ядра, а следовательно, и массу. Такие атомы, относящиеся к одному элементу, называются изотопами.
При химическом взаимодействии атомов образуются молекулы. Состав и строение молекул определяют состояние вещества при выбранных условиях и его свойства. Например, диоксид углерода СО2 при обычных условиях - газ, взаимодействующий с водой, а диоксид кремния SiO2 – твердое полимерное вещество, в воде не растворяющееся. При химических явлениях молекулы разрушаются, но атомы сохраняются. Во многих химических процессах атомы и молекулы могут переходить в заряженное состояние с образованием ионов – частиц, несущих избыточный положительный или отрицательный заряды.
Основные законы и понятия химии
Закон сохранения массы.Масса веществ, вступающих в реакцию, равна массе веществ, образующихся в результате реакции (М.В. Ломоносов, 1748-1756гг.). … Благодаря этому закону, химия перешла от науки качественной к количественной.… Закон сохранения энергии.При любых взаимодействиях, имеющих место в изолированной системе, энергия этой системы…Химическая символика
В химической литературе широко используются и групповые названия элементов.Латинские корни некоторых элементов
Химические символы – не только сокращенные названия элементов: они выражают и…Групповые названия элементов
Классы неорганических веществ
Все вещества делятся на простые (элементарные) и сложные. Простые вещества состоят из одного элемента, в состав сложных входит два или более элементов. Простые вещества, в свою очередь разделяются на металлы и неметаллы.
Металлы отличаются характерным «металлическим» блеском, ковкостью, тягучестью, могут прокатываться в листы или вытягиваться в проволоку, обладают хорошей теплопроводностью и электрической проводимостью. При комнатной температуре все металлы (кроме ртути) находятся в твердом состоянии.
Неметаллы не обладают характерным для металлов блеском, хрупки, очень плохо проводят теплоту и электричество. Некоторые из них при обычных условиях газообразны.
Сложные вещества делят на органические, неорга-нические и элементоорганические. Неорганическая химия охватывает химию всех элементов периодической системы. Свойства органических соединений существенно отличаются от свойств неорганических, а элементоорганические соедине-ния, с учетом их специфики, занимают промежуточное положение. С классификацией органических и элементоорга-нических соединений удобнее познакомиться при изучении соответствующих разделов химии, посвященных этим соединениям.
Неорганические вещества разделяются на классы либо по составу (двухэлементные, или бинарные, соединения и многоэлементные соединения; кислородсодержащие, азотосо-держащие и т.п.), либо по химическим свойствам, т.е. по функцииям (кислотно-основным, окислительно-восстанови-тельным и т.д.), которые эти вещества осуществляют в химических реакциях, - по их функциональным признакам.
К важнейшим бинарным соединениям относятся любые соединения только двух различных элементов. Например, бинарными соединениями азота и кислорода являются: N2O, NO, N2O3, NO2, N2O5; бинарные соединения меди и серы: Cu2S, CuS, CuS2. В формулах бинарных соединений металлы всегда предшествуют неметаллам: SnCl2, Al3N. Если бинарное соединение образовано двумя неметаллами, то на первом месте ставится символ того элемента, который располагается левее в следующей последовательности:
B, Si, C, As, P, H, Te, Se, S, I, Br, Cl, N, O, F.
Например, CBr4, H2O, SF6.
Если бинарное соединение состоит из двух металлов, то первым указывается металл, располагающийся в большом периоде раньше (от начала периода). Если оба металла находятся в одной группе, то первым указывается элемент с большим порядковым номером.
Бинарные соединения подразделяются на классы в зависимости от типа неметалла (табл. 1.2.), а остальные бинарные соединения относят к соединениям между металлами – интерметаллидам.
Классы бинарных соединений от типа неметалла
| Класс | Неметалл | Пример форму-лы соединения | Название |
| Галогениды | F, Cl, Br, I | NaCl | Хлорид натрия |
| Оксиды | O | FeO | Оксид железа (II) |
| Халькогениды | S, Se, Te | ZnS | Сульфид цинка |
| Пниктогениды | N, P, As | Li3N | Нитрид лития |
| Гидриды | H | CaH2 | Гидрид кальция |
| Карбиды | C | SiC | Карбид кремния |
| Силициды | Si | FeSi | Силицид железа |
| Бориды | B | Mg3B2 | Борид магния |
Их названия образуются из латинского корня названия неметалла с окончанием «ид» и русского названия менее электроотрицательного элемента в родительном падеже (табл. 3). Если менее электроотрицательный элемент может находиться в разных окислительных состояниях, то после его названия в скобках указывают римскими цифрами его степень окисления. Так, Cu2O - оксид меди (I), CuO- оксид меди (II), CO - оксид углерода (II), CO2 - оксид углерода (IV), SF6 - фторид серы (VI). Можно также вместо степени окисления указывать с помощью греческих числительных приставок (моно-, ди-, три-, тетра-, пента-, гекса- и т.д.) стехиометрический состав соединения: СО – монооксид углерода (приставку «моно» часто опускают), СО2 – диоксид углерода, SF6 – гексафторид серы, Fe3O4 – тетраоксид трижелеза. Для отдельных бинарных соединений сохраняют традиционные названия: Н2О – вода, NН3 – аммиак, РН3 – фосфин.
1.3.1. Оксиды.Оксиды - сложные вещества, бинарные соединения, состоящие из двух элементов, один из которых является кислород. Атомы кислорода в оксидах связаны ионно или ковалентно с атомами электроположительного элемента и не связаны друг с другом. Например:
 O
O



 Na Al О
Na Al О
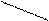 O Mg = O O Si
O Mg = O O Si
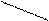

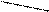
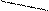
 Na Al O O
Na Al O O
Na2 O MgO Аl2O3 SiO2
оксид оксид оксид оксид
натрия магния алюминия кремния
Оксиды образуют почти все химические элементы. При образовании названия к слову оксид добавляется название элемента в родительном падеже. Если элемент проявляет переменную степень окисления, то ему соответствует несколько оксидов. В таких случаях при названии оксидов указывается степень окисления римской цифрой в скобках: Fe+2O –оксид железа (II), Fe+32 O3 – оксид железа (III), S+4O2 – оксид серы (IV), S+6О3 – оксид серы (VI) и др.
По химическим свойствам оксиды можно разделить на солеобразующие(их большинство) и несолеобразующие (безразличные). Примером несолеобразующих оксидов могут служить такие, как NO, N2O.Они не образуют солей. Солеобразующие оксиды подразделяются на кислотные, основные и амфотерные.
К кислотнымотносят оксиды типичных неметаллов (SО3, N2O5, CO2, P2O5, Сl2O7), а также оксиды некоторых металлов в их высшей степени окисления (СrO3, V2O5, Mn2O7 и др.). Этим оксидам соответствуют кислоты.
Основные оксиды - это оксиды типичных металлов: Na2O, MgO, BaO, CuO, Fe2O3 и др. Им соответствуют гидроксиды (основания).
К амфотерным относятся оксиды некоторых металлов: ZnO, Al2O3, SnO, Сr2O3, РbО и др. Они обладают одновременно свойствами кислотных и основных оксидов. В данной работе амфотерные оксиды и гидроксиды не рассматриваются.
Получение оксидов
1.Взаимодействие простых веществ с кислородом:
2Mg + O2 =t° 2MgO;
S + О2 =t° SO2
2. Разложение гидроксидов:
Mg(OH)2 =t° = MgO + H2O;
Cu(OH)2 =t° CuO + H2O
3. Разложение кислородных кислот при комнатной температуре и при нагревании:
Н2СО3 ↔ Н2О + СО2;
4HNO3 =t° 4NO2 + 2Н2О + О2; 2Н3BO3 =t° В2О3 + ЗН2О
4.Разложение солей кислородных кислот:
СаСО3 =t° СаО + СО2;
Fe2(SO4)3 =t° Fe2O3 + 3SO3
5. Разложение оксидов, образованных металлом в высшей степени окисления:
4СrO3 =t° 2Сr2О3 + ЗО2
Известны и другие способы получение оксидов, но они применяются редко.
Свойства оксидов
1.Большинство кислотных оксидов взаимодействуют с водой, образуя кислоты:
СО2 + Н2О ↔ Н2СО3;
SO3 + Н2О ↔ H2SO4
Оксид кремния (IV) SiO2,а так же кислотные оксиды некоторых металлов (WO3, MoO3)не взаимодействуют с водой. Из основных оксидов в воде растворимы только оксиды щелочных (Li2O, Na2O, K2O)и щелочноземельных металлов (СаО, SrO, BaO),при этом образуются соответствующие гидроксиды:
Na2O + H2O = 2NaOH
ВаО +Н2О =Ва(ОН)2
Оксиды остальных металлов с водой не реагируют и соответствующие им гидроксиды получают косвенным путем.
2. Кислотные оксиды взаимодействуют с гидроксидами и их растворами, образуя соль и воду:
SO3 + 2NaOH = Na2SO4 + Н2О;
СО2 + Са(ОН)2 = ↓ СаСОз + Н2О.
Основные оксиды взаимодействуют с кислотами, также образуя соль и воду:
CuO + H2SO4 = CuSO4 + H2O
Fe2O3 + 6HCl = 2FeCl3 + 3H2O
3.Взаимодействие кислотных оксидов с основными приводит к образованию солей:
SO3 + Na2O = Na2SO4
SiO2 + CaO = CaSiO3
1.3.2. Кислоты.Кислоты - это электролиты, диссоциирующие в водных растворах с образованием только катионов водорода.
HCl ↔ H+ + Cl ¯ ; CH2COOH ↔H+ + CH3COO¯
Кислоты по своему химическому составу могут быть кислородными (HNO3, HNO2, H2SO4, Н2СО3и др.) бескислородными (Н2S, НСl, HF, HBr, HCN) и др. Названия кислородных кислот происходят от названия кислото-образователя (центрального атома). Например, Н2СО3 – угольная кислота.
Если элемент – кислотообразователь проявляет перемен-ную степень окисления и образует несколько кислородных кислот, то в названиях кислот с высшей степенью окисления элемента употребляется -ная, -вая, с наименьшей степенью окисления элемента -истая: HNO3– азотная; HNO2– азотистая; H2SO4 – серная; H2SO3 – сернистая; НМnO4 –марганцевая; Н2МnO4 – марганцовистая. В тех случаях, когда элемент в одной и той же степени окисления образует несколько кислородных кислот, отличающихся между собой количеством атомов водорода и кислорода, к названию кислот добавляются приставки: мета – (наименьшее количество атомов водорода и киcлорода): орто – (наибольшее количество атомов водорода и кислорода). Например, НРО3– метафосфорная кислота, Н3РO4 – ортофосфорная кислота.
Некоторые кислотообразующие элементы при одной и той же степени окисления образуют несколько кислот, молекулы которых отличаются числом атомов кислотообразователя. Эти кислоты называются изополикислотами. В названии кислоты содержится приставка из русского числительного, показы-вающая число атомов кислотообразователя в ее молекуле. Например: Н2S2О7– двусерная кислота; Н2B4O7 – четырех-борная кислота; H4P2O7–двуфосфорная кислота; Н2Сr2О7- двухромовая кислота.
Названия наиболее часто употребляемых кислот и кислотных остатков
Кроме того, кислоты подразделяются по числу водород-ионов, способных "отщепляться" при диссоциации, на одноосновные (НСl, НNО3, СН3СООН),… Основность килоты зависит от количества кислотных остатков, соответствующих… Двух- и многоосновные кислоты диссоциируют ступенчато, т. е. их молекулы последовательно отщепляются по одному…Получение кислот
SO3 + Н2О=H2SO4; N2O5 + Н2О=2HNO3 2. Взаимодействие солей с кислотами (наиболее распространенный способ).Номенклатура неорганических соединений (по правилам ИЮПАК)
1.4.1. Названия для групп элементов.Элементы классифицируются как металлы,… Допускается использование следующих групповых названий: щелочные металлы (от Li до Fr), щелочноземельные металлы (от…Глава 2. Строение атома
Первые модели атома
В 1910 г. в лаборатории Э. Резерфорда (Англия) в опытах по бомбардировке металлической фольги α – частицами было установлено, что некоторые… В 1910 г. Резерфорд предложил ядерную планетарную модель атома, состоящего из…Атомные спектры
При нагреве вещество испускает лучи (излучение). Если излучение имеет одну длину волны, то оно называется монохроматическим. В большинстве же… (1)Кванты и модель Бора
(2) где h – постоянная планка (6,626 · 10-34 Дж· с); ν = с / λ, с – скорость света;Двойственная природа электрона
В 1924 г. Луи де Бройль (Франция) выдвинул предположение, что электрон также характеризуется корпускулярно-волновым дуализмом. Позднее это было… λ = h / (mv) (5) Волны частиц материи де Бройль назвал материальными волнами. Они свойственны всем частицам или телам. Однако, как…Энергетические подуровни
n l Обозначение подуровней Число подуровней 1s один 0,… Согласно пределам изменений орбитального квантового числа от 0 до (n-1), в каждом энергетическом уровне возможно…Значения квантовых чисел и максимальное число электронов на квантовых уровнях и подуровнях
Эти квантовые числа связаны с физическими свойствами электрона, и число n (главное квантовое число) характеризует энергетический (квантовый) уровень…Глава 3. Периодическая система Д.И. Менделеева
3.1. Периодический закон и структура периоди-ческой системы Д.И. Менделеева
Тема строения вещества является центральной в теоретической части курса химии и рассматривается в неразрывной связи с периодическим законом и его графическим изображением – периодической системой Д.И. Менделеева.
Развитие атомистических представлений в XIX веке завершилось открытием в 1869 г. Д.И. Менделеевым периодического закона и созданием периодической системы.«Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов»- такова первоначальная, авторская формулировка периодического закона. Наглядным выражением закона служит периодическая система Д.И. Менделеева. К настоящему времени предложено большое число вариантов системы. Наиболее общепризнанными являются короткая и длинная системы.
Периодический закон сыграл огромную роль в развитии химии как науки, в систематизации химических элементов по их важнейшим свойствам, в открытии новых элементов. Периодический закон и периодическая система явились необходимой базой для развития нового этапа в химии – познания структуры атома. В свою очередь, теория строения атома привела к эволюции периодического закона, позволила вскрыть сущность периодичности, выяснить природу взаимосвязи и различия химических элементов, объяснить закономерности периодической системы. Из рассмотрения электронных структур атомов элементов вытекает вывод о причинах периодичности: свойства элементов повторяются периодически через определенные интервалы (через 2, 8, 18, и т.д. элементов), т.к. периодически повторяются одни и те же внешние электронные структуры атомов: электронные аналоги являются и химическими аналогами.
В основе представлений о структуре атома лежит ядерная модель атома Резерфорда (1911 г.), согласно которой в центре атома находится положительно заряженное ядро; вокруг ядра располагаются отрицательно заряженные электроны (электрон – частица с ничтожно малой массой); число электронов равно заряду ядра, так что атом в целом электронейтрален. Радиус атома измеряется ангстремами (1Ǻ=10-8 см), радиус ядра не превышает 10-13 см, следовательно, по размерам ядро в 100000 раз меньше атома. Тем не менее, вся масса атома сосредоточена в ядре и плотность ядерного вещества огромна. Если бы удалось собрать 1 см3 атомных ядер (в действительности это невозможно из-за ядерных сил отталкивания), то их масса составила бы 116 млн. тонн.
Работами Резерфорда и Мозли (1921 г.) было установлено, что заряд ядра атома равен порядковому номеру элемента в периодической системе элементов Д.И. Менделеева. Например, порядковый номер атома азота N равен 7, следовательно, положительный заряд его ядра +7 и вокруг ядра находится 7 электронов.
Заряд ядра – важнейшая и фундаментальная характеристика атома, на ее основе дается современное понятие химического элемента:«Химическим элементом называется вид атомов с определенным зарядом ядра».
В ядре атома находятся два вида частиц: протоны и нейтроны. Протоны – это положительно заряженные частицы с зарядом +1 и массой 1 (точнее, 1,0076). Число протонов равно порядковому номеру элемента. Нейтроны – это нейтральные частицы с массой 1 (точнее, 1,0089)
Вся масса атома сосредоточена в ядре, следовательно, атомная масса элемента – суммарная масса протонов и нейтронов. Чтобы найти число нейтронов (N) в ядре любого атома, нужно из атомной массы (A) вычесть порядковый номер (Z) : N=A-Z. Например, для атома азота число протонов Z=7, число нейтронов N=14-7=7. Атомы одного и того же элемента, имеющие одинаковый заряд ядра, но разную массу, называются изотопами. Изотопы одного и того же химического элемента, согласно определению, имеют одинаковое число протонов, но разное число нейтронов. Например, для изотопов водорода имеют место соотношения, приведенные в табл. 7.
Изотопы водорода
Атомная масса элемента, указанная в периодической системе, определяется как средняя величина из масс всех его изотопов, взятых в процентном… Электроны в атоме располагаются по электронным слоям, или энергетическим… Согласно этой формуле, в первом электронном слое может разместиться не более 2 электронов, во втором – не более 8, в…Периодическая система элементов Д.И. Менделеева и электронная структура атомов
Первый период состоит из двух элементов: водорода и гелия. Атомом гелия заканчивается формированием К - оболочки атома, обозначим ее [Не].…Электронные конфигурации элементов первых двух периодов
У элементов второго периода формируется L - оболочка,заполняются s- и р-подоболочки. Формирующими электронами у первых двух элементов являются… Третий период начинается с натрия, электронная конфигурация которого… Рис. 2 Примерная схема относительного располо-жения энергетических подуровней в многоэлект-ронных…Электронные конфигурации элементов
Четвертый период завершается формированием подоболочки 4р у криптона [Ar] 3d°4s24p6 или [Кг]. Всего в четвертом периоде 18 элементов. Пятый период аналогичен четвертому периоду. Он начинается с s -элемента… В шестом периоде, как и в пятом, после заполнения s -подоболочки начинается формирование d-подоболочки предвнешнего…Периодические свойства элементов
Количественно-химическая активность элементов может быть выражена с помощью таких характеристик, как энергия (потенциал) ионизации, сродство к… Энергия ионизации. Энергия, необходимая для удаления одного моля электронов от… Na0 – ē = Na+ – 5,14 эвЭлектроотрицательность элементов по Полингу
Электроотрицательность элементов (табл. 10) возрастает по периоду и несколько убывает в группах с возрастанием номера периода у элементов I, II,… Таким образом наибольшие значения ОЭО имеют типичные неметаллы, наименьшие –… Атомные радиусы. Атомы не имеют строго определенных границ из-за корпускулярно-волнового характера электронов.…Степени окисления мышьяка, селена, брома
Решение. Электронные формулы данных элементов 25Mn 1s22s22p63s23p63d54s2 35Br 1s22s22p63s23p63d104s24p5Сокращенные и полные уравнения ядерных реакций
Глава 4. Химическая связь и строение молекул
Определение химической связи
Современная теория химической связи была предложена в 1916 г. американским ученым Льюисом и одновременно с 'ним немецким ученым Косселем. В… В образовании химических связей участвуют не все электроны атома, а только… Прежде валентностью элемента называли его способность присоединять или замещать определенное число атомов других…Ионная связь
Если на внешнем уровне содержится максимальное число электронов, которое атом может вместить, то такой уровень называется завершенным. Завершенные… Ионный тип связи возможен только у элементов, атомы которых резко отличаются… Рассмотрим электронное строение атомов некоторых металлов. неметаллов и инертного газа неона.Ковалентная связь
4.3.1. Неполярная ковалентная связь. Механизм возникновения ковалентной связи… - Образование молекулы Н2. Ядро свободного атома водорода окружено сферически симметричным электронным облаком. При…. . . .
Н ∙ + ∙ С1 : →Н:С1:
∙ ∙ ∙ ∙
Здесь происходит перекрывание s-облака атома водорода и р-облака атома хлора (рис. 10).
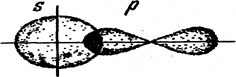
Рис. 10. Схема образования химической связи в молекуле хлороводорода.
Но в данном случае хлор обладает большей относительной электроотрицательностью. Поэтому происходит оттягивание электронной плотности к атому хлора. В молекуле возникает положительный и отрицательный полюсы.Химическая связь, в которой электронная плотность смещена к одному из партнеров, называется гетерополярной или полярной ковалентной связью. Критерием способности атома притягивать электрон может служить электроотрицательность. Чем выше ЭО у атома, тем более вероятно смещение электронной пары в сторону ядра данного атома. Поэтому разность электроотри-цательности атомов характеризует полярность связи.
Вследствие смещения электронной пары к одному из ядер повышается плотность отрицательного заряда у данного атома и соответственно атом получает заряд, называемый эффективным зарядом атома δ -. У второго атома повышается плотность положительного заряда δ +. Вследствие этого возникает диполь, представляющий собой электрически нейтральную систему с двумя одинаковыми по величине положительным и отрицательным зарядами, находящимися на определенном расстоянии (длина диполя) lд друг от друга. Мерой полярности связи служит электрический момент диполя равный произведению эффективного заряда на длину диполя lд
μСВ = δ lд
Электрический момент диполя имеет единицу измерения кулон на метр (Кл∙м). В качестве единицы измерения используют также внесистемную единицу измерения дебай D, равную 3,3-10–30 Кл∙м
Полярную ковалентную связь с δ, приближающемуся к 1, можно считать ионной связью. Однако, даже у ионных соединений δ ниже единицы. Поэтому любая ионная связь имеет определенную долю ковалентности.
Химическая связь в большинстве химических соединений сочетает свойства ковалентной и ионной связи. Поэтому ее можно считать ковалентной с определенной долей ионности. Степень ионности характеризуется эффективным зарядом атомов и возрастает с увеличением разности электроотрицательностей.
Рассмотренный выше механизм образования ковалентной связи (неполярной и полярной) называется обменным. Возможен и другой механизм образования ковалентной связи — донорно-акцепторной. В этом случае химическая связь возникает за счет двухэлектронного облака одного атома и свободной орбитали другого. В качестве примера рассмотрим механизм образования иона аммония NH+:
NH3 + H+ → [NH4]+
В молекуле аммиакаазот имеет неподеленную пару электронов (двухэлектронное облако). Уиона водорода свободна ls-орбиталь. При сближении двухэлектронное облако азота становится общим как для атома азота, так и для атома водорода, т. е. оно превратилось в молекулярное электронное облако. А значит, возникла четвертая ковалентная связь. Процесс образования иона аммония можно представить схемой:
H H
 .. . . +
.. . . +

 H : N : + H+ → H NH :
H : N : + H+ → H NH :
˙˙ ˙ ˙
H H
Атом, предоставляющий неподеленную электронную пару, называется донором, а атом, принимающий ее (т. е. предоставляющий свободную орбиталь), называется акцептором. Механизм образования ковалентной связи за счет двухэлектронного облака одного атома (донора) и свободной орбитали другого атома (акцептора) называется донорно-акцепторным.
Таким образом, в катионе аммония четыре равноценные ковалентные связи: три образованные по обменному механизму и одна - по донорно-акцепторному.
Вещества с полярной ковалентной связью занимают по свойствам промежуточное положение между веществами с ионной связью и неполярной ковалентной связью. Ковалентному типу связи характерны атомные и молекулярные кристаллические решетки.
Провести границу между ионной и полярной ковалентными связями не всегда возможно. В соединениях, образованных тремя и более элементами, между атомами могут быть различные типы химической связи.
4.3.3. Свойства ковалентной связи.Ковалентная связь обычно характеризуется длиной связи, энергией связи, насыщаемостью и направленностью.
Длиной связи называется межъядерное расстояние между химически связанными атомами, когда силы притяжения уравновешены силами отталкивания и энергия системы минимальна. Химическая связь тем прочнее, чем меньше ее длина. Однако количественной мерой прочности связи являетсяее энергия.
Энергиясвязи равна тойэнергии, которая необходима для разрыва имеющихся в молекулесвязей.Обычно она измеряется в килоджоулях, отнесенных к 1 моль вещества, т. е. к 6,02 · 1023 связям. Так, согласно опытным данным, длины связи молекул водорода, хлора и азота соответственно составляют 0,074, 0,198 и 0,109нм(нанометра), а энергии связи соответственно равны 436, 242 и 946 кДж/моль. С увеличением кратности связи энергия связи увеличивается, а длина уменьшается.
Насыщаемость— это полное использование атомом валентных орбиталей. В результате он становится неспособным к установлению дополнительных связей. Например, нельзя присоединить еще атом водорода к молекулам Н2 или СН4. В этих молекулах связи насыщены. Благодаря насыщаемости связей молекулы имеют определенный состав: Н2, Н2О, НСl и т. д.
Направленность ковалентной связи обусловливает пространственную структуру молекул, т. е. их геометрию (форму). Ковалентная связь возникает в направлении максимального перекрывания электронных облаков (орбиталей) вдоль линии соединения атомов. При образовании молекулы НС1 происходит перекрывание s-орбитали атома водорода с р-орбиталью атома хлора. Молекула имеет линейную форму. Химические связи в молекуле воды направлены под углом 104,5°.
Ковалентные связи, образуемые многовалентными атомами, всегда имеют пространственную направленность. Углы между связями называются валентными.
Метод валентных связей (МВС, ВС)
Метод валентных связей описывает механизм возникновения ковалентной связи и базируется на следующих основных принципах: 1. Химическая связь между двумя атомами осуществляется за счет одной или… Оба электрона общей электронной пары удерживаются одновременно двумя ядрами, что энергетически более выгодно, чем…Метод молекулярных орбиталей (ММО, МО)
Как известно, основное положение метода ВС состоит в том, что связь между атомами осуществляется за счет электронных пар (связующих двухэлектронных… Метод ВС не объясняет также роли неспаренных электронов в молекуле. Молекулы,… Чтобы объяснить эти факты, был предложен метод молекулярных орбиталей (ММО).Основные положения ММО, МО.
2. В молекуле каждому электрону соответствует молекулярная орбиталь, подобно тому как каждому электрону в атоме соответствует атомная орбиталь. И… АО s, p, d, f МО σ, π, δ, φГибридизация орбиталей и пространственная конфигурация молекул
Решение. Метод валентных связей (ВС) не может объяснить целый ряд свойств и строение некоторых молекул (парамагнетизм молекулы О2; большую… … = πCB2pz<πразр2py=πразр2pz< σразр2xМеталлическая связь
Из-за низкой энергии ионизации электроны в металле утрачивают связь с отдельными атомами, легко обобществляются, образуя электронный газ —… Теперь можно представить металл как плотно упакованную структуру положительных… Химическая связь, образующаяся в результате электрического притяжения между ионами металла и обобществленными…Водородная связь
Природу водородной связи объясняли по-разному. Наибольшее распространение получило электростатическое взаимодействие. Механизм водородной связи рассмотрим на примере молекулы воды. При образовании… Процесс образования водородной связи на примере двух молекул воды может быть представлен следующей схемой (точками…Взаимодействия между молекулами
4.8.1. Вандерваальсовы силы.В 1873 г. голландский ученый И. Ван-дер-Ваальс… Диполь-дипольное взаимодействие. При сближении полярных молекул они ориентируются таким образом, чтобы…Вклад отдельных составляющих в энергию межмолекулярного взаимодействия
Дисперсионное притяжение. В любой молекуле или атоме благородного газа… Энергия вандерваальсова взаимодействия. Энергия всех видов вандерваальсова взаимодействия обратно пропорциональна…Глава 5 . Энергетика химических процессов
Науку о взаимных превращениях различных видов энергии называют термодинамикой. Термодинамика устанавливает законы этих превращений, а также направление самопроизвольного течения различных процессов в данных условиях.
Общие понятия
а) изобарическими (р = const); б) изохорическими (Т= const); в) изотермическими (Т = const);Внутренняя энергия. Первый закон термодинамики
При любом процессе соблюдается закон сохранения энергии как проявление более общего закона природы — закона сохранения материи. Теплота Q,… Q = ∆U + A Количественное соотношение между изменением внутренней энергии, теплотой и работой устанавливает первый закон…Энтальпия системы. Тепловые эффекты химических реакций
А = рV, где V — изменение объема системы (V2 – V1). Так как большинство химических реакций проходит при постоянном давлении, то для изобарно-изотермического процесса (р =…Термохимические расчеты
Часто в термохимических расчетах применяют следствиеиззакона Гесса: тепловой эффект реакции (Нx.p.) равен сумме теплот образования Нобр продуктов… ∆Hx.p. = ∑∆Hобрпрод - ∑∆Hобрисх (1) Пример 1.… Решение. Уравнения реакций, в которых около символов химических соединений указываются их агрегатные состояния или…Стандартные теплоты (энтальпии) образования
Решение. Теплотой образования (энтальпией) данного соединения называют тепловой эффект реакции образования 1 моль этого соединения из простых… Обычно теплоту образования относят к стандартному состоянию, т.е. 25° С (298… 2С(графит)+3Н2(г) = С2Н6(г); ∆H = ?Химическое сродство. Энтропия химических реакций. Энергия Гиббса
Реакция, идущая при данной температуре с выделением теплоты, при другой температуре проходит с поглощением теплоты. Здесь проявляется диалектический… Энтропия S, так же как внутренняя энергия U, энтальпия Н, объем V и др.,… ∆Sx.p.=∑S0прод - ∑S0исхВторой и третий законы термодинамики
Второй закон термодинамики имеет статистический характер, т.е. справедлив лишь для систем, состоящих из очень большого числа частиц. Однако, если в системе протекает химическая реакция, то система обменивается… В отличие от других термодинамических функций, можно определить не только изменение, но абсолютное значение энтропии.…Глава 6. Химическая кинетика и равновесие
Кинетика — учение о скорости различных процессов, в том числе химических реакций. Критерием принципиальной осуществимости реакций является неравенство 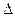 Gp.T.<0. Но это неравенство не является полной гарантией фактического течения процесса в данных условиях, не является достаточным для оценки кинетических возможностей реакции. Так, ∆G0298 H2O (u) = - 228,59 кДж/моль, a ∆G0298 АlI3(к) = -313,8 кДж/моль и, следовательно, при T = 298 К и р= 1,013.105 Па возможны реакции, идущие по уравнениям:
Gp.T.<0. Но это неравенство не является полной гарантией фактического течения процесса в данных условиях, не является достаточным для оценки кинетических возможностей реакции. Так, ∆G0298 H2O (u) = - 228,59 кДж/моль, a ∆G0298 АlI3(к) = -313,8 кДж/моль и, следовательно, при T = 298 К и р= 1,013.105 Па возможны реакции, идущие по уравнениям:
Н2(г) + 1/2О2(г) = Н2О(г)
2А1(к) + 3I2(к) = 2A1I3(к)
Однако эти реакции при стандартных условиях идут только в присутствии катализатора (платина для первой и вода для второй). Катализатор как бы снимает кинетический «тормоз» и проявляется термодинамическая природа вещества.
Понятие о скорости химических реакций
Различают среднюю скорость химической реакции за данный промежуток времени и истинную скорость реакции в данный момент времени. Если в момент… Знак минус пишут в том случае, если концентрация вещества во времени уменьшается (исходное вещество), а знак плюс –…Зависимость скорости реакции от концентрации реагентов
Для реакции, протекающей по уравнению А + В = С + Д, этот закон выразится уравнением: V = kCA ∙ CB (1) где: СА и СВ – молярные концентрации вещества А и В;Влияние температуры на скорость реакции
где: - скорости реакции соответственно при началом (t1) и конечной (t2)… γ – температурный коэффициент скорости реакции, который показывает, во сколько раз увеличится скорость реакции с…Энергия активации
Химическое превращение происходит тогда, когда возникают условия для перераспределения электронной плотности столкнувшихся частиц. Этот процесс… Реакционно-способную систему можно охарактеризовать тремя последовательно… [начальное] → [переходное] → [конечное]Понятие о катализе и катализаторах
Различают положительный и отрицательный катализ. В случае положительного катализа скорость химической реакции при введении катализатора возрастает,… Химические реакции, протекающие в присутствии катализаторов, называются… Различают два вида катализа – гомогенный (однородный) и гетерогенный (неоднородный) катализ.Химическое равновесие. Принцип Ле Шателье
Химическое равновесие – такое состояние системы реагирующих веществ, при котором скорости прямой и обратной реакций равны между собой. Химическое равновесие называют динамическим равновесием. Этим подчеркивается,… Концентрации реагирующих веществ, которые устанавливаются при химическом равновесии, называются равновесными…Глава 7. Растворы
Раствором называется твердая или жидкая гомогенная система, состоящая из двух или более компонентов (составных частей), относительные количества которых могут изменяться в широких пределах. Наиболее важный вид растворов – жидкие растворы. Раствор состоит из растворенных веществ и растворителя, т.е. среды, в которой эти вещества равномерно распределены в виде молекул или ионов.
Способы выражения концентрации растворов
Различают массовую, молярную (мольно-объемную), моляльную, титр, мольную долю и другие величины, выражающие содержание растворенного вещества в… Пример 1. Вычислите: а) массовую (процентную) (с, %); б) молярную концентрацию… Решение: а) Массовая концентрация показывает число граммов (единиц массы) вещества, содержащееся в 100 г (единиц…Коллигативные свойства растворов
Молекулы нелетучего растворенного компонента раствора препятствуют улетучиванию из раствора молекул растворителя. Французский ученый Р. Рауль открыл… р0А –рА = ∆рА = р0АхВ, где р0А, рА - давления насыщенного пара растворителя соответственно над чистым растворителем и над раствором;Растворы электролитов
Растворы электролитов являются ионными проводниками (проводниками второго рода). В них наблюдаются отклонения от законом Рауля и Вант-Гоффа.… РОСМ = iсRT Изотонический коэффициент характеризует отклонение от законов деальных растворов вследствие электролитической…Например, для раствора КС1
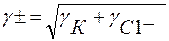
для раствора А12(SO4)3
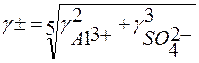
Коэффициенты активности зависят от природы растворителя и растворенного вещества, от концентрации раствора, а также от температуры (табл. 18).
Коэффициенты активности некоторых электролитов
В растворах при 298 К
Как видно из табл. 18 коэффициенты активности меняются в очень широких пределах: в области разбавленных растворов они стремятся к единице, в то… I = 0,5 Σ cizi2 (3) Правило ионной силы позволяет рассчитать коэффициенты активности отдельных ионов в разбавленных растворах.…Гидролиз солей
Гидролизу не подвергаются соли, образованные сильными кислотами и основаниями, например КС1. Гидролиз соли, образованной слабой кислотой и сильным… CH3COONa → СН3СОО – + Na+ Вода, как уже указывалось, является слабым электролитом:Константы и степени диссоциации некоторых слабых электролитов
в) Сульфат цинка ZnSO4 — соль слабого многокислотного основания Zn(OH)2 и сильной кислоты H2SO4. В этом случае катионы Zn2+ связывают гидроксильные… Zn2+ + H2O ↔ ZnOH+ + H+ или в молекулярной формеГлава 8. Окислительно-восстановительные
Процессы
8.1 Степень окисления элементов В простых веществах химическая связь - ковалентная неполярная. В двухцентровой двухэлектронной связи связывающая…Валентности и степени окисления атомов в некоторых соединениях
Три электрона азота образуют три σ -связи с соседними атомами кислорода и еще два - делокализованную трехцентровую π -связь с атомами… Таким образом, степень окисления характеризует валентность и… Введено понятие степени окисления для характеристики состояния элементов в соединениях. Под степенью окисления (С.О.)…Окислительно-восстановительные реакции
1. Окислением называют процесс отдачи электронов атомом, молекулой или ионом. Степень окисления при этом повышается. Например: А1 - 3ē = А13+ Н2 - 2ē = 2Н+ Fe2+ - ē = Fe3+ 2С1– - 2ē = С12Важнейшие восстановители и окислители
При окислительно-восстановительных реакциях валентность атомов может и не меняться. Например, в окислительно-восстановительной реакции Н02 + С102 =…Составление уравнений окислительно-восстановительных реакций
Метод электронного баланса является более простым и учитывает изменение степени окисления элементов в реакциях. Ионно-электронный метод учитывает… 8.3.1. Метод электронного баланса.Подбор коэф-фициентов в реакции методом электронного баланса осуществляется по…Определение комплексных соединений
Такие соединения, как оксиды, кислоты, основания, соли образованы из атомов в результате возникновения между ними химической связи. Это соединения… Однако имеются вещества, которые образованы в результате соединения друг с… K2S04 + A12 (S04)3 = K2S04·AI2 (SО4)3 = 2KA1 (SO4)2Комплексообразователи
Комплексообразователями служат атомы или ионы, имеющие вакантные орбитали. Способность к комплексообразованию возрастает с увеличением заряда иона и уменьшением его размера. К наиболее распространенным комплексообразователям относятся ионы d-элементов VII, VIII, I и II групп периодической таблицы элементов.
Лиганды
Динатриевая соль ЕДТА и сама кислота относятся к классу соединений,…Номенклатура комплексных соединений
Число лигандов обозначают греческими приставками (ди-, три-, тетра- и т.д.) или бис-, трис-, тетракис-, пентакис- и гексакис- для 2, 3, 4, 5 и 6… Комплексный анион записывается аналогично названию катиона, но с добавлением…Диссоциация комплексных соединений
Комплексные соединения — электролиты при диссоциации в водных растворах образуют комплексные ионы, например: [Ag (NH3)2] CI ↔[Ag (NH3)2]+ +С1– К [Ag (CN)2 ↔K+ + [Ag (CN)2]-Константы устойчивости комплексов
КУСТ = 1/ КН Тогда для иона [Ag(NH3)2]+:Роль комплексных соединений
Рис.25. Струк-тура молекул порфина Комплексы с участием порфина называются порфи-ринами. Они отличаются друг от друга… виде порфиновый цикл представлен четырьмя атомами азота, соединеннымиСписок используемой литературы
1. Алексеев, В.Н. Курс качественного химического анализа / В.Н.Алексеев. – М.: Химия, 1973. –432 с.
2. Ахметов, Н.С. Общая и неорганическая химия: учебник для вузов / Н.С. Ахметов– М.: Высш. шк., 1981. – 679 с.
3. Глинка, Н.Л. Задачи и упражнения по общей химии: учебное пособие для вузов / Н.Л. Глинка; под ред. В.А. Рабиновича и Х.М. Рубинной. - 22-е изд., испр. и доп. – Л.: Химия, 1983. – 264 с.
4. Глинка, Н.Л. Задачи и упражнения по общей химии: Учебное пособие для вузов / Н.Л. Глинка; под ред. В.А. Рабиновича и Х.М. Рубиной. – М.: Интеграл – Пресс, 2001. – 240 с.
5. Глинка, Н.Л. Общая химия / Н.Л. Глинка - М.: Химия, 2000.
6. Глинка, Н.Л. Общая химия: учебное пособие для вузов / Н.Л. Глинка; под ред. А.И. Ермолова. – 29-е изд., исправленное – М.: Интеграл – Пресс, 2001. – 728 с.
7. Гольбрайх, З.Е. Сборник задач и упражнений по химии / З.Е. Гольбрайх. - М.: Высш. шк. – 1968.
8. Гуранов, С.С. Строение атома и химическая связь / С.С. Гуранов. -М.: Изд-во МГУ, 1972.
9. Дорохова, Е.Н. Аналитическая химия: физико-химические методы анализа / Е.Н. Дорохова, Г.В. Прохорова - М.: Высшая шк., 1991.
10. Жолнин, А.В. Строение атома. Химическая связь / А.В. Жолнин. - Челябинск.: Изд-во ЧМА, 1995. – 24 с.
11. Жолнин, А.В. Химическая кинетика и равновесие/ А.В. Жолнин. - Челябинск: Изд-во ЧМА, – 1995.
12. Золотов, Ю.А. Основы аналитической химии / Ю.А. Золотов. -.М: Высш. шк., 1999.
13. Зубович, И.А. Неорганическая химия: учеб. для технол. спец. Вузов / И.А. Зубович. - – М.: Высш. шк., 1989. – 432 с.
14. Карапетьянц, М.Х., Общая и неорганическая химия: учеб. пособие для вузов / М.Х. Карапетьянц, С.И. Дракин. – М.: Химия, 1981. – 632 с.
15. Кириченко, Э.А. Строение атома и химическая связь / Э. А. Кираченко. - М.: Наука, 1972.
16. Князев, Д.А., Неорганическая химия: учеб. для вузов по спец. «Агрохимия и почвоведение / Д.А. Князев, С.Н. Самарыгин. – М.: Высш. шк., 1990. – 430 с.
17. Коровин, Н.В. Общая химия / Н.В. Коровин - М.: Высш. шк., 1998.
18. Коровин, Н.В. Общая химия: учеб. для технических направ. и спец. Вузов / Н.В. Коровин. – М.: Высш. шк., 1998. – 559 с.
19. Кульман, А.Г. Общая химия / А.Г. Кульман. – 3-е изд., перераб. и доп. – М.: Колос, 1979. – 528 с. – (Учебники и учебные пособия для высш. с.-х. учеб. заведений).
20. Методика к решению задач и упражнений по аналитической химии / Н.А. Киприянов, Ю.Н.Жванко, И.С. Савицкая, С.С. Кондратенко; под ред. М.С. Чернова.- М.: Полиграфист, 1976. – 96 с.
21. Николаев, Л.А. Неорганическая химия: уеб. пособие для студентов пед. институтов по хим. и биол. спец. / Л.А. Николаев. - 2-е изд. перераб. – М.: Просвещение, 1982. – 640 с.
22. Небылицин, В.Д. Номенклатура неорганических соединений : метод. пособие для студентов специальности «Химия» / В.Д. Небылицин.- Челябинск: ЧГУ, – 1984. – 9с.
23. Общая химия. Биофизическая химия. Химия биогенных элементов: учеб. для вузов / Ю.А. Ершов, В.А. Попков, А.С. Берлянд и др.; под ред. Ю.А. Ершова. – 2-е изд. , испр. и доп. – М.: Высш. шк., 2000. – 560 с.
24. Романцева, Л.М. Сборник задач и упражнений по общей химии: учеб. пособие для нехим. спец. вузов / Л.М. Романцева, З.Л. Лещинская, В.А. Суханова. – 2-е изд., перераб. и доп. – М.: Высш. шк., 1991. –288 с.
25. Химия и периодическая таблица: пер. с японск. / Сайто К., Хаякова С., Такен Ф., Ямадера Х.; под ред. К. Сайто. – М.: Мир, 1982. – 320 с.
26. Свиридов, В.В. Задачи, вопросы и упражнения по общей и неорганической химии: учебное пособие для хим. спец. вузов / В.В. Свиридов, Г.А. Попкович, Г.И. Васильева. – 2-е изд. перераб.- Мн.: Изд-во БГУ, 1982. – 382 с.
27. Угай, Я.А. Неорганическая химия: учеб. для хим. спец. Вузов / Я.А. Угай – М.: Высш. шк., 1989.-463 с.
28. Угай, Я.А. Общая и неорганическая химия: учеб. для студентов вузов, обучающихся по направлению и спец. «Химия» / Я.А. Угай. – М.: Высш. шк., 1997. – 527 с.
29. Неорганическая химия: программа и методические указания для студентов заочных факультетов МВА / Л.А.Фролова, Н.А. Князева, Н.И. Буряк, С.А. Рогожина, Р.Г.Суслова под ред. А.Ф. Арсеньева. - М.: [ МВА], 1980.
30. Фролова, Л.А. Окислительно-востоновительные реакции в курсе неорганической химии/ методические указания по программированному обучению для студентов МВА: Москва, - 1980. – 108с.
31. Хомченко, И.Г. Общая химия: учебник / И.Г. Хомченко – М.: Изд-во «Новая волна», 1997. – 464 с.
32. Шиманович, И.Л. Химия: методические указания, программа, решение типовых задач, программированные вопросы для самопроверки и контрольные задания для студентов-заочников инженерно-технических (нехимических) специальностей вузов/ И.Л. Шиманович. – 2-е изд. испр. – М.: Высш. шк., 2001. – 128 с.
Кафедра общей химии и экологического мониторинга
Уральской госуддрственной академии ветеринарной медицины
А.Р. Таирова
Основы неорганической химии
Учебное пособие
Редактор – Л.Р. Хусаинова
Сдано в набор 05.12.2006. Подписано в печать 11.12.2006
Формат А5 Печать оперативная. Бумага офсетная.
Лицензия №021252 от 31 октября 1997г.
Заказ № 285 Тираж 100 экз.
Редакционно-издательский отдел
ФГОУ ВПО «Уральская государственная
академия ветеринарной медицины»
Адрес: 457100, г. Троицк, Челябинская обл.,
ул. Гагарина, 13
Отпечатано в ООО «Мини Тип»
ИИН 744712565595
Адрес: 455007, г. Магнитогорск, Челябинская обл.,
ул. Менжинского, 13
Тел./факс:(3519)24-88-09, 24-88-10
Е- mail: minitip@mgn.ru
[1] Термины «координационные соединения» и «комплексные соединения» употребляются как синонимы.
[2] При записи степени окисления у символа элемента справа вверху указывают сначала знак, а затем цифру, в то время как для реально существующих ионов и эффективных зарядов атомов указывают сначала цифру, а потом знак. Например, запись Са+2 формально означает кальций в степени окисления +2, а запись Са2+ отвечает реально существующему иону кальция с зарядом 2+. Степень окисления элемента также указывают римской цифрой в скобках, следующей сразу без пробела за названием или символом элемента, например, записи: железо (III) и Fe (III) используются для обозначения железа в степени окисления +3.
[3] Постоянную степень окисления имеют щелочные элементы (+ 1), бериллий, магний, щелочноземельные элементы (+2), фтор (- 1). Для водорода в большинстве соединений характерна степень окисления +1, а в его соединениях с ч-элементами и в некоторых других соединениях она равна - 1. Степень окисления кислорода, как правило, равна - 2; к важнейшим исключениям относятся пероксидные соединения, где она равна - 1, и фторид кислорода OF2, в котором степень окисления кислорода равна +2.
Степень окисления иона элемента равна заряду иона.
Для элементов с непостоянной степенью окисления ее значение всегда нетрудно подсчитать, зная формулу соединения и учитывая, что сумма степеней окисления всех атомов в молекуле равна нулю.
[4] Приведенные примеры решают, применяя формулу Ж = m / (mЭ ∙ V)
где: т – масса вещества, обусловливающего жесткость воды или применяемого для устранения жесткости, мг;
mэ, – молярная масса эквивалента этого вещества;
V – объем воды, л.
– Конец работы –
Используемые теги: основы, неорганической, химии0.066
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ: ОСНОВЫ НЕОРГАНИЧЕСКОЙ ХИМИИ
Что будем делать с полученным материалом:
Если этот материал оказался полезным для Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Хотите получать на электронную почту самые свежие новости?







Новости и инфо для студентов