Гибридизация орбиталей и пространственная конфигурация молекул
| Тип молекулы | Исходные орбитали атома А | Тип гибридизации | Число гиб-ридных ор-биталей атома А | Пространствен-ная конфигу-рация моле-кулы |
| АВ2 АВ3 АВ4 | s+ р s + р+ р s+p+p+p | sp sp2 sp3 | Линейная Треугольная Тетраэдрическая |
Пример 9. Как метод молекулярных орбиталей (МО) описывает строение двухатомных гомоядерных молекул элементов второго периода?
Решение. Метод валентных связей (ВС) не может объяснить целый ряд свойств и строение некоторых молекул (парамагнетизм молекулы О2; большую прочность связей в молекулярных ионах F+2 и О+2, чем, соответственно, в молекулах F2 и O2; наоборот, меньшую прочность связи в ионе N+2 , чем в молекуле N2; существование молекулярного иона Не2+ и неустойчивость молекулы Не2 и т.п.). Более плодотворным оказался другой подход к объяснению ковалентной связи — метод молекулярных орбиталей (МО). В методе МО состояние молекулы описывается как совокупность электронных молекулярных орбиталей. При этом число молекулярных орбиталей равно сумме атомных орбиталей. Молекулярной орбитали, возникающей от сложения атомных орбиталей (АО), соответствует более низкая энергия, чем исходным орбиталям. Такая МО имеет повышенную электронную плотность в пространстве между ядрами, способствует образованию химической связи и называется связывающей. Молекулярной орбитали, образовавшейся от вычитания атомной, соответствует более высокая энергия, чем атомной орбитали. Электронная плотность в этом случае сконцентрирована за ядрами атомов, а между ними равна нулю. Подобные МО энергетически менее выгодны, чем исходные АО, они приводят к ослаблению химической связи и называются разрыхляющими. Электроны, занимающие связывающие и разрыхляющие орбитали, называют соответственно связывающими (cв) и разрыхляющими (разр). Заполнение молекулярных орбиталей происходит при соблюдении принципа Паули и правила Хунда по мере увеличения их энергии в такой последовательности:
σCB1s<σразр1s<σCB2s<σразр2s<σCB2px<πCB2py =
= πCB2pz<πразр2py=πразр2pz< σразр2x
На рис. 20 изображена энергетическая схема образования молекулярных орбиталей из атомных для двухатомных гомоядерных (одного и того же элемента) молекул элементов второго периода. Число связывающих и разрыхляющих электронов зависит от их числа в атомах исходных элементов.
Следует отметить, что при образовании молекул N2 энергия связывающей 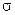 2рx-орбитали больше энергии связывающих
2рx-орбитали больше энергии связывающих 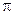 2ру- и
2ру- и 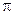 2рz-орбиталей, тогда как в молекулах О2 и F2, наоборот, энергия связывающих
2рz-орбиталей, тогда как в молекулах О2 и F2, наоборот, энергия связывающих 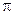 2ру- и
2ру- и 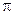 2рz-орбиталей больше энергии связывающей
2рz-орбиталей больше энергии связывающей 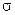 2рx-орбитали. Это нужно учитывать при изображении энергетических схем (см. рис. соответствующих молекул).
2рx-орбитали. Это нужно учитывать при изображении энергетических схем (см. рис. соответствующих молекул).
Порядок связи в молекуле определяется разностью между числом связывающих и разрыхляющих электронов, деленной на два. Порядок связи может быть равен нулю (молекула не существует),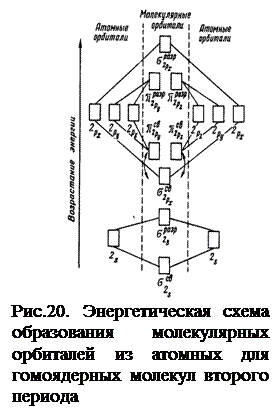 целому или дробному положительному числу.
целому или дробному положительному числу.
Подобно электронным фор-мулам, показывающим распреде-ление электронов в атоме по атомным орбиталям, в методе МО составляют формулы моле-кул, отражающие их электрон-ную конфигурацию. По аналогии с атомными s-, p-, d-, f-орбиталями молекулярные орби-тали обозначаются греческими буквами 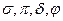 . Так, электронная конфигурация молекулы O2 записывается следующим образом:
. Так, электронная конфигурация молекулы O2 записывается следующим образом:
O2 [КК(σsCB)2(σsразр)2(σpxCB)2(πpyCB)2πpzразр πpyразр πpzразр]
Буквами КК показано, что четыре 1s-электрона (два связывающих и два разрыхляющих) практически не оказывают влияния на химическую связь.