Вклад отдельных составляющих в энергию межмолекулярного взаимодействия
| Ве-щест-во | Элект-ричес-кий момент диполя, D | Поля-ризуе-мость, м3∙1030 | Энергия взаимодействия, кДж/моль | Темпе-ратура кипе-ния К | |||
| ориен-таци-онная | индук-цион-ная | диспер-сионная | сум-мар-ная | ||||
| H2 Ar Xe HCl HBr HI NH3 | 1,03 0,78 0,38 1,52 | 0,8 1,64 4,16 2,64 3,62 5,42 2,23 | 3,3 1,1 0,6 13,3 | 1,0 0,70 0,3 1,5 | 0,17 8,5 18,4 16,8 28,5 60,6 14,7 | 0,17 8,5 18,4 21,1 30,3 61,5 29,5 | 20,2 239,6 |
Дисперсионное притяжение. В любой молекуле или атоме благородного газа возникают флуктуации электрической плотности, в результате чего появляются мгновенные диполи, которые в свою очередь индуцируют мгновенные диполи у соседних молекул (рис.21). Движение мгновенных диполей становится согласованным, их появление и распад происходит синхронно. В результате взаимодействия мгновенных диполей энергия системы понижается. Энергия дисперсионного взаимодействия пропорциональна поляризуемости молекул и обратно пропорциональна расстоянию между центрами частиц. Для неполярных молекул дисперсионное взаимодействие является единственной составляющей вандерваальсовых сил (табл. 14).
Энергия вандерваальсова взаимодействия. Энергия всех видов вандерваальсова взаимодействия обратно пропорциональна расстоянию между центрами молекул в шестой степени.
При сильном сближении молекул проявляются силы отталкивания между ними, которые обратно пропорции-ональны расстоянию: между молекулами-в двенадцатой ступени. Поэтому зависимость результирующей энергии вандерваальсова взаимодействия Ев от расстояния между молекулами, Iв, выражается уравнением
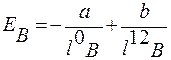
где: a и b — постоянные.
Минимальная энергия системы обеспечивается при расстояниях между центрами молекул 0,4÷0,5 нм, т.е. существенно больше длины химической связи.
Как видно из табл. 14, сувеличением размера молекул в ряду Аr-Хе и НС1-HI растет их поляризуемость и энергия дисперсионного притяжения. Ориентационное взаимодей-ствие вносит значительный вклад в вандерваальсовы силы лишь в случае молекул с большим электрическим моментом диполя. С увеличением суммарной энергии межмолекуляр-ного взаимодействия возрастает температура кипения жидкостей, атакже теплота их испарения.
Суммарная энергия вандерваальсового взаимодействия молекул на 1-2 порядка ниже энергии химических связей.
Итак, между молекулами возникают относительно слабые вандерваальсовы взаимодействия, включающие дисперсион-ные силы, а для полярных молекул и диполь-дипольное притяжение и индукционные взаимодействия.
4.8.2. Донорно-акцепторное взаимодействие молекул. Комплексные соединения.Если одна из двух молекул имеет атом со свободными орбиталями, а другая - атом с парой неподеленных электронов, то между ними происходит донорно-акцепторное взаимодействие, которое приводит к образованию ковалентной связи, например:
NH3 + BF3 = NH3BF3
У атома азота в молекуле аммиака имеется неподеленная пара электронов, а у атома бора в молекуле трифторида бора - вакантная орбиталь.
При взаимодействии по донорно-акцепторному механизму атом азота отдает на связь пару электронов, а атом бора - вакантную орбиталь, в результате чего возникает ковалентная связь
H F H F
| | | |
H – N + B – F → H – N – B – F
| | | |
H F H F
В полученном соединении суммарные валентности бора и азота равны четырем.
Комплексы. Аналогичным образом образуется соединение КРF6 при взаимодействии KF и PF5, которое можно записать в виде К[РF6].
При взаимодействии сульфата меди и аммиака образуется сложное соединение
CuSO4+4NH3=CuSO4 · 4NН3
которое выражается формулой [Сu(NН3)4]SO4. Сложные соединения, у которых имеются ковалентные связи, образованные по донорно-акцепторному механизму, получили название комплексных или координационных соединений. (см. главу 9).