Энтальпия системы. Тепловые эффекты химических реакций
Теплота Q и работа A функциями состояния не являются, ибо они служат формами передачи энергии и связаны с процессом, а не с состоянием системы. При химических реакциях А — это работа против внешнего давления, т.е. в первом приближении
А = р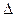 V,
V,
где 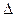 V — изменение объема системы (V2 – V1).
V — изменение объема системы (V2 – V1).
Так как большинство химических реакций проходит при постоянном давлении, то для изобарно-изотермического процесса (р = const, Т= const) теплота Qp будет равна:
Qp = ∆U + p∆V,
Qp= (U2 – U1) + p(V2 – V1)
Qp = (U2 + pV2) – (U1 + pV1)
Сумму U+ pV обозначим через Н, тогда
Qp = H2 – H1 = ∆H
Величину Н называют энтальпией. Таким образом, теплота при р=const и Т=const приобретает свойство функции состояния и не зависит от пути, по которому протекает процесс. Отсюда теплота реакции Qp в изобарно-изотермическом процессе равна изменению энтальпии системы 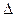 Н (если единственным видом работы является работа расширения):
Н (если единственным видом работы является работа расширения):
Qp = ∆H
Энтальпия, как и внутренняя энергия, является функцией состояния: ее изменение (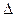 H) определяется только начальным и конечным состояниями системы и не зависит от пути перехода. Нетрудно видеть, что теплота реакции в изохорно-изотермическом процессе (V= const; Т = const), при котором
H) определяется только начальным и конечным состояниями системы и не зависит от пути перехода. Нетрудно видеть, что теплота реакции в изохорно-изотермическом процессе (V= const; Т = const), при котором 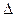 V=0, равна изменению внутренней энергии системы:
V=0, равна изменению внутренней энергии системы:
Qv = ∆U
Теплоты химических процессов, протекающих при р, Т=const и V, Т=const, называют тепловыми эффектами.
При экзотермических реакциях энтальпия системы уменьшается и 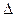 Н < 0 (Н2 < H1), а при эндотермических энтальпия системы увеличивается и
Н < 0 (Н2 < H1), а при эндотермических энтальпия системы увеличивается и 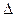 Н > 0 (Н2 > Н1). В дальнейшем тепловые эффекты всюду выражаются через
Н > 0 (Н2 > Н1). В дальнейшем тепловые эффекты всюду выражаются через 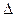 H.
H.