Второй и третий законы термодинамики
Для систем, которые не обмениваются с окружающей средой ни энергией, ни веществом (изолированные системы), второй закон термодинамики имеет следующую формулировку: в изолированных системах самопроизвольно идут только такие процессы, которые сопровождаются возрастанием энтропии: AS > 0.
Второй закон термодинамики имеет статистический характер, т.е. справедлив лишь для систем, состоящих из очень большого числа частиц.
Однако, если в системе протекает химическая реакция, то система обменивается энергией с окружающей средой, т.е. не является изолированной. Химические реакции обычно сопровождаются изменением как энтропии, так и энтальпии.
В отличие от других термодинамических функций, можно определить не только изменение, но абсолютное значение энтропии. Это вытекает из высказанного в 1911 г. М. Планком постулата, согласно которому «при абсолютном нуле энтропия идеального кристалла равна нулю». Этот постулат получил название третьего закона термодинамики.
Пример 1. В каком состоянии энтропия 1 моль вещества больше при одинаковой температуре: в кристаллическом или парообразном?
Решение. Энтропия есть мера неупорядоченности состояния вещества. В кристалле частицы (атомы, ионы) расположены упорядоченно и могут находиться лишь в определенных точках пространства, а для газа таких ограничений нет. Объем 1 моль газа гораздо больше объема 1 моль кристаллического вещества; возможность хаотичного движения молекул газа больше. А так как энтропию можно рассматривать как количественную меру хаотичности атомно-молекулярной структуры вещества, то энтропия 1 моль паров вещества больше энтропии 1 моль его кристаллов при одинаковой температуре.
Пример 2. Прямая или обратная реакция будет протекать при стандартных условиях в системе
СН4(г)+СО2 ↔ 2СО(г)+2Н2(г)
Решение. Вычислим  прямой реакции. Значения
прямой реакции. Значения  соответствующих веществ приведены в табл. 16. Зная, что
соответствующих веществ приведены в табл. 16. Зная, что 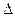 G есть функция состояния и что
G есть функция состояния и что 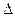 G для простых веществ, находящихся в устойчивых при стандартных условиях агрегатных состояниях, равны нулю, находим
G для простых веществ, находящихся в устойчивых при стандартных условиях агрегатных состояниях, равны нулю, находим  процесса:
процесса:
∆G0298 = 2 (-137,27) +2 (0) - (-50,79-394,38) = +170,63 кДж
То, что  > 0, указывает на невозможность самопроизвольного протекания прямой реакции при Т = 298К и давлении взятых газов равном 1,013 ∙ 105 Па (760 мм рт. ст. = 1 атм).
> 0, указывает на невозможность самопроизвольного протекания прямой реакции при Т = 298К и давлении взятых газов равном 1,013 ∙ 105 Па (760 мм рт. ст. = 1 атм).
16. Стандартная энергия Гиббса образования  некоторых веществ
некоторых веществ
| Вещест-во | Состоя-ние |  , кДж/моль , кДж/моль
| Вещест-во | Состоя-ние |  , кДж/моль , кДж/моль
|
| ВаСО3 | к | -1138,8 | FeO | к | -244,3 |
| СаСО3 | к | -1128,75 | Н2О | ж | -237,19 |
| Fе3O4 | к | -1014,2 | Н2O | г | -228,59 |
| ВеСО3 | к | -944,75 | PbO2 | к | -219,0 |
| СаО | к | -604,2 | СО | г | -137,27 |
| ВеО | к | -581,61 | СН4 | г | -50,79 |
| NaF | к | -541,0 | NO2 | г | +51,84 |
| ВаО | к | -528,4 | NO | г | +86,69 |
| СО2 | г | -394,38 | C2H2 | г | +209,20 |
| NaCl | к | -384,03 | |||
| ZnO | к | -318,2 |
17. Стандартные абсолютные энтропии  некоторых веществ
некоторых веществ
| Вещест-во | Состоя-ние |  , Дж/(моль.К) , Дж/(моль.К)
| Вещест-во | Состоя-ние |  ,
Дж/(моль.К) ,
Дж/(моль.К)
|
| С | Алмаз | 2,44 | Н2O | г | 188,72 |
| С | Графит | 5,69 | N2 | г | 191,49 |
| Fe | к | 27,2 | NН3 | г | 192,50 |
| Ti | к | 30,7 | СО | г | 197,91 |
| S | Ромб | 31,9 | с2H2 | г | 200,82 |
| TiO2 | к | 50,3 | O2 | г | 205,03 |
| FeO | к | 54,0 | H2S | г | 205,64 |
| H2O | ж | 69,94 | NO | г | 210,20 |
| Fе2О3 | к | 89,96 | CO2 | г | 213,65 |
| NH4C1 | к | 94,5 | C2H4 | г | 219,45 |
| СН3ОН | ж | 126,8 | Cl2 | г | 222,95 |
| Н2 | г | 130,59 | NO2 | г | 240,46 |
| Fе3O4 | к | 146,4 | РС13 | г | 311,66 |
| СН4 | г | 186,19 | PCl5 | г | 352,71 |
| НС1 | г | 186,68 |
Пример 3. На основании стандартных теплот образования (см. табл. 15) и абсолютных стандартных энтропий веществ (табл.17) вычислите 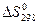 реакции, протекающей по уравнению
реакции, протекающей по уравнению
СО(г)+Н2О(ж)=СО2(г)+Н2(г)
Решение. 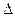 G0 =
G0 = 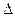 H0 - T
H0 - T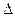 S0;
S0; 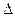 H и
H и 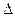 S – функции состояния, поэтому
S – функции состояния, поэтому
∆Н0х.р.=∑ ∆Н0прод - ∑ ∆Н0исх ; ∆S0x.p.= ∑S0прод - ∑ S0 исх
∆Н0х.р.=(-393,51+0) – (110,52 – 285,84) = +2,85 кДж
∆S0x.p.=(213,65+130,59)-(197,91+69,94) = +76,39 = 0,07639 кДж/(моль∙К);
∆G0= +2,85 – 298 ∙ 0,07639 = - 19,91 кДж
Пример 4. Реакция восстановления Fе2О3 водородом протекает по уравнению
Fe2O3(к)+3H2(г) = 2Fe(к)+3H2O(г) ; ∆Н=+96,61 кДж
Возможна ли эта реакция при стандартных условиях, если изменение энтропии 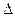 S=0,1387 кДж/(моль×К)? При какой температуре начнется восстановление Fе2О3?
S=0,1387 кДж/(моль×К)? При какой температуре начнется восстановление Fе2О3?
Решение. Вычисляем 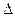 G0 реакции:
G0 реакции:
∆G = ∆Н-Т∆S = 96,61 – 298 ∙ 0,1387 = +55,28 кДж
Так как 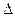 G > 0, то реакция при стандартных условиях невозможна; наоборот, при этих условиях идет обратная реакция окисления железа (коррозия). Найдем температуру, при которой
G > 0, то реакция при стандартных условиях невозможна; наоборот, при этих условиях идет обратная реакция окисления железа (коррозия). Найдем температуру, при которой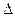 G=0:
G=0:
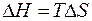

Следовательно, при температуре »696,5 К начнется реакция восстановления Fе2О3 Иногда эту температуру называют температурой начала реакции.
Пример 5.Вычислите 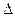 H0,
H0, 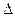 S и
S и 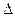 G0 реакции, протекающей по уравнению
G0 реакции, протекающей по уравнению
Fe2O3(к) + 3C = 2Fe + 3CO
Возможна ли реакция восстановления Fе2О3 углеродом при 500 и 1000 К?
Решение. 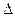 H0xp и
H0xp и 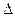 S0xp находим из соотношений (1) и (2) (см. разделы «Энергетика химических процессов. Термохимические расчеты» и «Химическое сродство»):
S0xp находим из соотношений (1) и (2) (см. разделы «Энергетика химических процессов. Термохимические расчеты» и «Химическое сродство»):
∆Н0x.p.= [3(-110,52)+2 ∙ 0] – [- 822,10 + 3 ∙ 0] = -331,56+822,10 = +490,54 кДж
∆S0x.p.=(2 ∙ 27,2+3 ∙ 197,91) – (89,96+3 ∙ 5,69) = 541,1 Дж/(моль ∙ К)
Энергию Гиббса при соответствующих температурах находим из соотношения
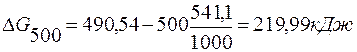

Так как 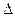 G500>0, a
G500>0, a 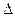 G1000<0, то восстановление Fе2О3 возможно при 1000 К и невозможно при 500 К.
G1000<0, то восстановление Fе2О3 возможно при 1000 К и невозможно при 500 К.